题目内容
537℃、1.01×105Pa 时,往容积可变的密闭容器中充入2mol SO2、1mol O2,此时容器的体积为200L.向容器中加入催化剂(固体)并保持恒温恒压,发生反应:2SO2(气)+O2(气)?2SO3(气)达到平衡时,平衡气体中SO3的体积分数为0.91.
试回答下列问题:
(1)工业上二氧化硫的催化氧化采用常压而不采用高压的原因是:
(2)保持上述温度和压强不变,若向容器中只充入2mol SO3并加入固体催化剂.则平衡时,SO2的体积分数是
(3)温度仍保持537℃,容器体积保持200L不变(恒容).充入a molSO2、b molO2,并加入固体催化剂,反应达平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105Pa.若a:b=2:1,则a=
试回答下列问题:
(1)工业上二氧化硫的催化氧化采用常压而不采用高压的原因是:
常压下,三氧化硫的含量已达到91%,从降低成本考虑,没有必要再加压
常压下,三氧化硫的含量已达到91%,从降低成本考虑,没有必要再加压
.(2)保持上述温度和压强不变,若向容器中只充入2mol SO3并加入固体催化剂.则平衡时,SO2的体积分数是
6%
6%
,容器的体积为137.3
137.3
L.(3)温度仍保持537℃,容器体积保持200L不变(恒容).充入a molSO2、b molO2,并加入固体催化剂,反应达平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105Pa.若a:b=2:1,则a=
2.9
2.9
.分析:(1)常压下三氧化硫的含量已很高,为节约成本,无需增大压强;
(2)利用三段式法结合等效平衡解答;
(3)达到平衡时,平衡气体中SO3的体积分数为0.91,a:b=2:1,与起始充入2molSO2、1molO2,达到平衡时状态相同,根据物质的量之比等于体积之比计算.
(2)利用三段式法结合等效平衡解答;
(3)达到平衡时,平衡气体中SO3的体积分数为0.91,a:b=2:1,与起始充入2molSO2、1molO2,达到平衡时状态相同,根据物质的量之比等于体积之比计算.
解答:解:(1)常压下三氧化硫的含量已很高,为节约成本,无需增大压强,因增大压强,需要增大设备的抗压能力,且消耗能源,
故答案为:常压下,三氧化硫的含量已达到91%,从降低成本考虑,没有必要再加压;
(2)达到平衡时,平衡气体中SO3的体积分数为0.91,
2SO2(g)+O2(g)?2SO3(g),
开始 2 1 0
转化 2x x 2x
平衡2-2x 1-x 2x
则
=0.91,解得x=0.94,
则平衡时,SO2的体积分数是(1-0.91)×
×100%=6%,
保持上述温度和压强不变,平衡时气体的总的物质的量为3mol-0.94mol=2.06mol,所以平衡时气体的总体积为V=
×200=137.3L,
故答案为:6%;137.3;
(3)体积始终保持200L,达到平衡时的体积也是200L,则加入二氧化硫的物质的量为
=2.9mol,故答案为:2.9.
故答案为:常压下,三氧化硫的含量已达到91%,从降低成本考虑,没有必要再加压;
(2)达到平衡时,平衡气体中SO3的体积分数为0.91,
2SO2(g)+O2(g)?2SO3(g),
开始 2 1 0
转化 2x x 2x
平衡2-2x 1-x 2x
则
| 2x |
| 3-x |
则平衡时,SO2的体积分数是(1-0.91)×
| 2 |
| 3 |
保持上述温度和压强不变,平衡时气体的总的物质的量为3mol-0.94mol=2.06mol,所以平衡时气体的总体积为V=
| 2.06 |
| 3 |
故答案为:6%;137.3;
(3)体积始终保持200L,达到平衡时的体积也是200L,则加入二氧化硫的物质的量为
| 200×2 |
| 137.3 |
点评:本题考查化学平衡的计算及等效平衡,注意把握温度、体积、压强的条件,判断两种状态为等同的平衡状态是解答的关键,易错点为题中恒压和恒容两种条件,答题时不要忽视,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
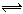 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。