题目内容
9.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为NH4HCO3+HCl→NH4Cl+CO2↑+H2O△H=+Q kJ•mol-1 |
分析 醋酸逐渐凝固,说明环境温度降低,则NH4HCO3和盐酸的反应是吸热反应,反应物总能量小于生成物总能量,以此解答该题.
解答 解:A.醋酸逐渐凝固说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO3与HCl的反应为吸热反应,故A错误;
B.因反应为吸热反应,即吸热的热量转化为产物内部的能量,故B正确;
C.因反应为吸热反应,则反应后生成物的总能量高于反应物的总能量,故C错误;
D.书写热化学方程式时,应注明物质的状态,故D错误.
故选B.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力,注意把握热化学方程式书写方法,能量守恒的应用分析是解题关键,题目难度中等.

练习册系列答案
相关题目
8.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况).它在光照条件下与氯气反应能生成三种不同的一氯取代物,该烃的结构简式是( )
| A. |  | B. | CH3-CH2-CH2-CH2-CH3 | ||
| C. | 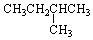 | D. |  |
9.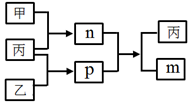 短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
 短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )| A. | 原子半径:A<B<C | |
| B. | BD2分子中所有原子都达到了8电子稳定结构 | |
| C. | C与D的简单氢化物沸点,后者高 | |
| D. | 非金属性:D>C>B |
6.下列离子方程式正确的是( )
| A. | Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+═SO42-+3S↓+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ | |
| C. | 盐碱地(含较多NaCl、Na2CO3)中加入石膏,降低土壤的碱性,涉及的方程式为:Ca2++CO32-═CaCO3↓ | |
| D. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O |
4.有温度、容积相同的甲、乙两个密闭容器.往甲容器中通入1g N2和1g H2,乙容器中通入2g N2和2g H2,保持恒温、恒容达到平衡,相关参数比较正确的是( )
| A. | 平衡时N2的转化率:α甲>2α乙 | B. | 平衡时NH3的浓度:2c甲<c乙 | ||
| C. | 平衡时体系压强:2p甲>p乙 | D. | 反应放出的热量:2Q甲>Q乙 |
14.用丁达尔效应能区分的一组物质是( )
| A. | NaCl溶液和NaOH溶液 | B. | 稀硫酸和稀醋酸 | ||
| C. | Fe(OH)3胶体和溴水 | D. | Ba(OH)2溶液和澄清石灰水 |
1.下列仪器为滴定管的是( )
| A. |  | B. |  | C. |  | D. |  |
18. 在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )
在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )
 在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )
在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )| A. | 每消耗0.lmol乙二醛,在Pt1极放出2.24L气体(标准状况) | |
| B. | Pt1的电极反应为:4OH--4e-=2H2O+O2↑ | |
| C. | 每得到1mol乙二酸将有2molH+从右室迁移到左室 | |
| D. | 盐酸是起提供Cl-和增强导电性的作用 |
19.下列实验方案能达到实验目的是( )
| A. | 用苯和饱和溴水制溴苯 | |
| B. | 用浓盐酸和铁粉制少量氢气 | |
| C. | 用NaOH溶液除去MgC12溶液中的AlC13杂质 | |
| D. | 用右图所示装置制备乙酸乙酯 |