题目内容
用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
| A.C(H+)>C(OH-) | B.C(CH3COOH)+C(CH3COO-)=0.2 mol/L |
| C.C(CH3COOH)>C(CH3COO-) | D.C(CH3COO-)+C(OH-)=0.2 mol/L |
B
CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知C(CH3COO-)>C(Na+),根据电荷守恒C(CH3COO-)+C(OH-)=C(Na+)+C(H+),可得出C(OH-)<C(H+)。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。

练习册系列答案
相关题目
 、
、 、
、 、
、
 、
、 、
、 、
、 、
、 、
、
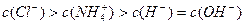
 )
) )+c(HS
)+c(HS