题目内容
【题目】镁是一种重要的金属资源,在各领域都具有重要的作用。
(1)皮江法炼镁是我国生产镁的重要方法,其实质是在高温和真空条件下,有氧化钙存在时,通过硅还原氧化镁生成镁蒸气,与反应生成的固体硅酸二钙(2CaO·SiO2)相互分离,并经冷凝得到结晶镁。写出该反应的化学反应方程式 。
电解槽中先得到的是镁的蒸气,镁蒸气可以在下列 (填编号)气体氛围中冷却。
A.空气 B.氮气 C.水蒸气 D.氢气
(2)目前发达国家80%的镁来自于电解熔融氯化镁。电解原料无水氯化镁可由海水制备。主要有以下步骤:①在干燥的HCl气流中加热脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶。
其步骤先后顺序是_____________________(步骤可重复使用);在干燥的HCl气流中加热时,能得到无水MgCl2,其原因是______________________。
(3)已知某温度下Mg(OH)2的Ksp=6.4×l012,当溶液中c(Mg2+)≤1.0×105mol·L1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥_______________mol·L1。
(4)在Mg(OH)2悬浊液中滴入饱和NH4Cl溶液,溶液变澄清。反应原因可能有两个:一是NH4+水解产生H+,H+再与Mg(OH)2反应;二是_____________________(用离子方程式表示)。要验证谁是Mg(OH)2溶解的主要原因,可选取________代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
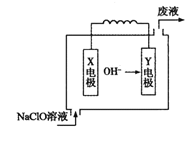
(5)镁电池是近年来科学技术研究的热点之一,下图为Mg—NaClO燃料电池结构示意图。其工作时Mg作 (填“X”或“Y”)电极,正极的电极反应式: 。
【答案】
(1)2MgO+Si+2CaO![]() 2CaO·SiO2+2Mg↑(2分) D(1分)
2CaO·SiO2+2Mg↑(2分) D(1分)
(2)②④③⑤④①(2分) 营造酸性氛围抑制Mg2+的水解并及时带走水蒸气(2分)
(3)8×10-4 (2分)
(4)2NH4+ +Mg(OH)2 =2 NH3H2O + Mg2+(2分) C(1分)
(5)Y(1分) ClO- + 2e- + H2O = Cl- +2OH-(2分)
【解析】
试题分析:
(1)皮江法炼镁是在高温和真空条件下,有氧化钙存在时,通过硅还原氧化镁生成镁蒸气,并生成的固体硅酸二钙(2CaO·SiO2)。由此该反应的化学反应方程式为2MgO+Si+2CaO![]() 2CaO·SiO2+ 2Mg↑。电解槽中得到的镁蒸气可以在氢气氛围中冷却,因其他物质均能与镁反应,故选D。
2CaO·SiO2+ 2Mg↑。电解槽中得到的镁蒸气可以在氢气氛围中冷却,因其他物质均能与镁反应,故选D。
(2)海水中Mg以镁离子形式存在,所以先加入熟石灰,使其转化为氢氧化镁沉淀、过滤后加入稀盐酸,转化为氯化镁溶液,蒸发浓缩结晶,不能将溶液蒸干,因为氯化镁水解生成氢氧化镁和氯化氢,加热促进水解,所以待溶液中出现大量固体时,停止加热,冷却后再过滤得氯化镁晶体,最后在干燥的HCl气流中脱水干燥得氯化镁固体,所以步骤先后顺序是②④③⑤④①;因为氯化镁水解生成氢氧化镁和氯化氢,加热促进水解,所以为防止水解,在HCl气流中加热晶体。
(3)某温度下Mg(OH)2的Ksp=6.4×l012,当溶液中c(Mg2+)≤1.0×105mol·L1可视为沉淀完全,则Ksp=c(Mg2+)×c2 (OH-),所以c(OH-)2≥6.4×l012/1.0×105mol·L1=64×l08,c(OH-)≥8×10-4mol/L。
(4)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是白色沉淀逐渐溶解,溶液变澄清;可能的原因是因为氢氧化镁的悬浊液中存在溶解平衡,氯化铵溶液水解呈酸性,酸与氢氧化镁发生中和反应而使其溶解;或者铵根离子与氢氧化镁溶解产生的氢氧根离子结合为一水合氨,使氢氧化镁溶解平衡中的氢氧根离子浓度减小,平衡正向移动,沉淀溶解,离子方程式是2NH4+ +Mg(OH)2 =2 NH3H2O + Mg2+;要验证谁是Mg(OH)2溶解的主要原因,选择含有铵根离子且溶液呈中性的盐,A、B溶液均呈酸性,与氯化铵的效果相同,D为碱性不能选,而醋酸铵溶液呈中性,加入醋酸铵,若沉淀仍溶解,则是铵根离子的作用,所以答案选C。
(5)由图中OH—向负极移动,那么Y为负极,故镁作Y电极;原电池中,ClO- 在正极发生还原反应,与水结合生成氯离子和氢氧根离子,ClO- + 2e- + H2O = Cl- +2OH-。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案