题目内容
1.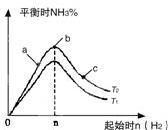 某科研小组研究在其他条件不变的情况下,改变起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):(1)比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c.
(2)若容器容积为1L,N2的物质的量为1mol,n(H2)=3mol,反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=2.08.
(3)合成氨工厂常通过测定反应前后混合气体的密度来确定氮的转化率.某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况).该合成氨厂N2的转化率25%.
分析 (1)三点时温度相同,氢气量越大,氮气的转化率越大;
(2)N2(g)+3H2(g)?2NH3(g)
起始(mol) 1 3 0
转化(mol) 0.6 1.8 1.2
平衡(mol) 0.4 1.2 1.2
容器容积为1L,所以c(H2)=1.2mol/L,c(N2)=0.4mol/L,c(NH3)=1.2mol/L,据此求算平衡常数;
(3)先根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算反应前混合气体中N2和H2的体积比,然后根据M=ρVm=$\frac{m}{n}$求出转化率;
解答 解:(1)三点时温度相同,氢气量越大,氮气的转化率越大,则c点的转化率最高,
故答案为:c;
(2)N2(g)+3H2(g)?2NH3(g)
起始(mol) 1 3 0
转化(mol) 0.6 1.8 1.2
平衡(mol) 0.4 1.2 1.2
容器容积为1L,所以c(H2)=1.2mol/L,c(N2)=0.4mol/L,c(NH3)=1.2mol/L,反应的平衡常数K=$\frac{1.{2}^{2}}{0.4×1.{2}^{3}}$=2.08,
故答案为:2.08;
(3)设反应前混合气体中氮气的物质的量分数为x,氢气物质的量分数为(1-x),依题意得:
28x+2(1-x)=0.5536×22.4 解得x=0.4
所以N2、H2的物质的量之比为2:3
设起始N2的物质的量为2mol,H2为3 mol,N2的转化量为y
N2 +3H2 ?2NH3
起始(mol) 2 3 0
转化(mol) y 3y 2y
平衡(mol) 2-y 3-3y 2y
总物质的量=2-y+3-3y+2y=(5-2y)mol
$\frac{(28×2+2×3)}{(5-2y)}$=0.693×22.4(左右都是反应后气体的摩尔质量)
y=0.5 mol
所以N2的转化率为$\frac{0.5}{2}$×100%=25%,
故答案为:25%.
点评 本题考查化学平衡的计算,明确化学平衡的三段法计算及图象的分析试剂解答本题的关键,题目难度中等,注意三段式解题法的利用.

| A. | 在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| C. | 在试管中加入少量氯化钴晶体,滴加浓盐酸溶解后加水稀释至紫色,将试管置于热水中片刻,溶液颜色变成粉红色 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色逐渐变浅 |
| A. | 纯水具有较弱的导电性 | B. | 水分子在任何条件下都能发生电离 | ||
| C. | 常温下水能发生电离 | D. | 水的电离是一个可逆反应 |
 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14 mol•L-1 | |
| B. | b点:c(NH${\;}_{4}^{+}$)+c(NH3•H2O)=c(Cl-) | |
| C. | c点:c(Cl-)=c(NH${\;}_{4}^{+}$) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
(1)现有雨水样品1份,每隔一段时间测定数据如下:
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 |
①酸雨放置时,pH发生变化的主要原因是(用化学方程式表示)2H2SO3+O2=2H2SO4.
②如果将刚取样的上述雨水与少量新鲜自来水混合,pH将变小(填“变大”、“变小”或“不变”).
(2)你认为以下哪些做法是减少酸雨产生的途径①③⑤
①少用煤作燃料 ②把烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
(3)下列物质不属于“城市空气质量日报”报道的是C
A.二氧化硫B.氮氧化物C.二氧化碳D.可吸入颗粒物.
H2O2→H2O IO${\;}_{3}^{-}$→I2 MnO${\;}_{4}^{-}$→Mn2+ HNO2→NO
如果分别用1mol这些物质氧化足量的KI,得到I2的物质的量分为:
| 氧化剂 | I2的物质的量(mol) | 氧化剂 | I2的物质的量(mol) |
| H2O2 | IO3- | ||
| MnO4- | HNO2 |
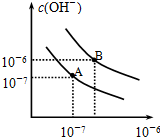 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: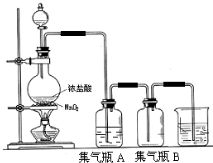 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O