题目内容
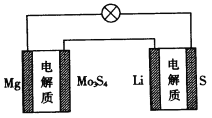
【题目】已知:镁电池的总反应为xMg+Mo3S4![]() MgxMo3S4,锂硫电池的总反应为2Li+S
MgxMo3S4,锂硫电池的总反应为2Li+S![]() Li2S。下列说法正确的是
Li2S。下列说法正确的是
A.镁电池放电时,Mg2+向负极迁移
B.镁电池放电时,正极发生的电极反应为Mo3S4+2xe-= Mo3S42-
C.理论上两种电池的比能量相同(参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量)
D.图中Li作负极,Mo3S4作阳极
【答案】B
【解析】
试题分析:A、放电时,相当于原电池原理,电池内部Mg2+向正极移动,故A错误;B、放电时,相当于原电池原理,负极发生失电子的氧化反应,电极反应为:Mg-2e-=Mg2+,总反应-负极反应=正极反应:Mo3S4+2xe-= Mo3S42-,故B正确;C.比能量是参与电极反应的单位质量的电极材料放出电能的大小,锂硫电池放电时负极为Li,镁电池放电时负极为镁,两种电池的负极材料不同,所以比能量不同,故C错误;D、图相当于一个是原电池,一个是电解池,若Li作负极,则Mo3S4作阴极,故D错误。故选B。

练习册系列答案
相关题目
