题目内容
(14分).下表是部分短周期元素的原子半径及主要化合价:
试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。M在Z的最高价氧化物中燃烧的化学方程式为 。
(2) 元素Z可形成多种同素异形体,其中有属于原子晶体的,写出它的名称
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有 ;X可与w组成含18电子的共价化合物乙,则乙的电子式为 。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为 mol·L-1。
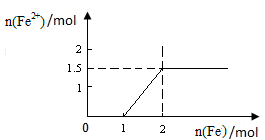
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。
| 元素代号 | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | -3,+5 | +2 |
(1)七种元素中原子半径最大的元素在周期表中位置是 。M在Z的最高价氧化物中燃烧的化学方程式为 。
(2) 元素Z可形成多种同素异形体,其中有属于原子晶体的,写出它的名称
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有 ;X可与w组成含18电子的共价化合物乙,则乙的电子式为 。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为 mol·L-1。
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。

(14分).(1)第三周期IA族; 2Mg+CO2==2MgO+C
(2)金刚石
(3)离子,共价键;
(4)5.6×10—10 mol/L
(2)金刚石
(3)离子,共价键;

(4)5.6×10—10 mol/L
W、R、X、Y、Z、Q、M对应元素分别为H、Na、O、N、C、P、Mg;
(1)七种元素中原子半径最大的元素是Na,位于周期表中第三周期,IA族;Z的最高价氧化物为CO2,其反应方程式为:2Mg+CO2=====2MgO+C;
(2)元素碳可形成多种同素异形体,其中有属于原子晶体的为:金刚石;
(3)X可与R按1:l的原子个数比形成离子化合物甲为Na2O2,存在离子键、非极性键;X可与w组成含18电子的共价化合物乙为H2O2;电子式为: ;
;
(4)5.6×10—10 mol/L
(5)铁与硝酸反应的方程式为: ,1mol铁与4mol硝酸恰好完全反应生成1mol +3铁,再加入铁则发生反应:
,1mol铁与4mol硝酸恰好完全反应生成1mol +3铁,再加入铁则发生反应: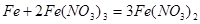 ;1mol +3铁完全反应后生成1.5mol+2铁;则
;1mol +3铁完全反应后生成1.5mol+2铁;则
(1)七种元素中原子半径最大的元素是Na,位于周期表中第三周期,IA族;Z的最高价氧化物为CO2,其反应方程式为:2Mg+CO2=====2MgO+C;
(2)元素碳可形成多种同素异形体,其中有属于原子晶体的为:金刚石;
(3)X可与R按1:l的原子个数比形成离子化合物甲为Na2O2,存在离子键、非极性键;X可与w组成含18电子的共价化合物乙为H2O2;电子式为:
 ;
;(4)5.6×10—10 mol/L
(5)铁与硝酸反应的方程式为:
 ,1mol铁与4mol硝酸恰好完全反应生成1mol +3铁,再加入铁则发生反应:
,1mol铁与4mol硝酸恰好完全反应生成1mol +3铁,再加入铁则发生反应: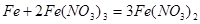 ;1mol +3铁完全反应后生成1.5mol+2铁;则
;1mol +3铁完全反应后生成1.5mol+2铁;则

练习册系列答案
相关题目
 :
:
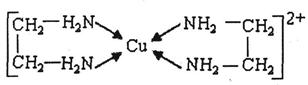
 。
。 中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。
中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。
 氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
氧化剂或氯化剂,能与许多有机物反应。请回答下列问题: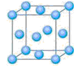
 分子的空间构型是_______。
分子的空间构型是_______。 成的合金。
成的合金。 态碳(C)原子的价电子排布式为 。
态碳(C)原子的价电子排布式为 。 种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中
种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中 每个镁原子周围距离最近的镍原子有 个。
每个镁原子周围距离最近的镍原子有 个。