题目内容
|
室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是 | |
A. |
0.01 mol·L-1的盐酸溶液和0.01 mol·L-1的氨水溶液 |
B. |
pH=2的盐酸溶液和pH=12的氢氧化钡溶液 |
C. |
pH=2的醋酸溶液和pH=12的氢氧化钠溶液 |
D. |
pH=2的盐酸溶液和pH=12的氨水溶液 |

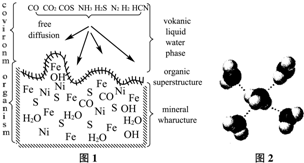
A. 海底热液研究(图1)处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物。
(1) Ni2+的核外电子排布式是____________________。
(2) 分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是 。
| 电离能/kJ·mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
(3) 下列说法正确的是________。
A. 电负性:N>O>S>C B. CO2与COS(硫化羰)互为等电子体
C. NH3分子中氮原子采用sp3杂化 D. CO、H2S、HCN都是极性分子
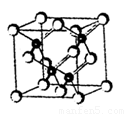
(4) “酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为________________。
(5) FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是____________________________________________。在FeS晶胞中,与Fe2+距离相等且最近的S2-围成的多面体的空间构型为________________。
B. 制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离。下面是某化学兴趣小组的活动记录:
|
| NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
实验方案:
Ⅰ. 溶解:称取29.8g KCl和34.0g NaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解。
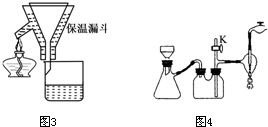
Ⅱ. 蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩。在100℃时蒸发掉50.0g 水,维持该温度,在保温漏斗(如图所示)中趁热过滤析出的晶体。得晶体m1g。
Ⅲ. 冷却结晶:待溶液冷却至室温(实验时室温为10℃)后,进行减压过滤。得KNO3粗产品m2g。
Ⅳ. 重结晶:将粗产品全部溶于水,制成100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
假定:① 盐类共存时不影响各自的溶解度;② 各种过滤操作过程中,溶剂的损耗忽略不计。试回答有关问题:
(1) 操作Ⅱ中趁热过滤的目的是 。
(2) 若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,则理论上在操作Ⅲ中可得粗产品的质量m2=______g,其中混有NaCl______g。为防止NaCl混入,在操作Ⅱ中承接滤液的烧杯中至少应加入蒸馏水______g。
(3) 操作Ⅲ中采用减压过滤,其优点是______________________________________。该小组同学所用的装置如右图所示,试写出该装置中主要用到的玻璃仪器的名称:________________。若实验过程中发现倒吸现象,应采取的措施是______________________________________。
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.