题目内容
下列说法中正确的是
| A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 |
| C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0 |
| D.ΔH的大小与热化学方程式的计量系数无关 |
C
解析试题分析:A、在化学反应过程中,发生物质变化的同时一定发生能量变化,这是化学变化的特征之一,A不正确;B、生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为放热反应,B不正确;C、反应物的总能量大于生成物的总能量,反应就是放热反应,反之是吸热反应。因此反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0,C正确;D、ΔH的大小与热化学方程式的计量系数成正比,而不是没有关系,D不正确,答案选C。
考点:考查影响反应热大小的有关判断

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是 ( )
A.C(s)+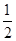 O2(g)=CO(g) ΔH=-393.5 kJ/mol O2(g)=CO(g) ΔH=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=+571.6 kJ/mol |
C.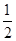 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol |
已知C2H2(g)+ 5/2 O2(g)=2CO2(g) + H2O(l) △H=-1300kJ·mol-1,则下列说法正确的是( )
| A.当有20NA个电子转移时,放出2600kJ 热量 |
| B.当有4NA个碳氧共用电子对生成时,放出1300kJ热量 |
| C.若生成NA个水蒸气分子焓变为△H0,则△H0<△H |
| D.上述反应为吸热反应 |
下列说法正确的是
| A.蓄电池充电时其负极应与外电源的的正极相连接 |
| B.同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的△H相同 |
C.已知:H2(g)+I2(g)  2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 |
| D.已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ·mol-1 |
在298 K、100 kPa时,已知:
2H2O(g)=O2(g)+2H2(g);ΔH1
Cl2(g)+H2(g)=2HCl(g);ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g);ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
在一定条件下,A和B反应可生成C和D,其能量变化如下:
下列有关反应A+B=C+D的说法正确的是( )
| A.反应前后原子的种类和数目可能改变 |
| B.该反应若有热量变化,则一定是氧化还原反应 |
| C.若该反应为放热反应,则不需加热反应就一定能进行 |
| D.该反应遵循能量守恒,所以一定有能量变化 |
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) 2XY3(g) △H=-92.6kJ·mol-1
2XY3(g) △H=-92.6kJ·mol-1
起始时各物质物质的量如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | ||
| X2 | Y2 | XY3 | |
| ① | 1 | 3 | 0 |
| ② | 0.6 | 1.8 | 0.8 |
达到平衡后,①容器中XY3的物质的量为0.5mol。下列叙述正确的是
A.容器①、②中反应的平衡常数不相等
B.达平衡时,容器②中 XY3的物质的量浓度为2mol·L—1
C.容器①中反应达到平衡时放出的热量为23.15 kJ
D.容器②中反应达到平衡时放出热量
下列对有关反应能量变化图像的判断错误的是( )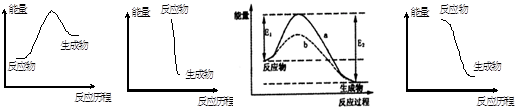
I Ⅱ Ⅲ Ⅳ
| A.I可表示需加热的放热反应 |
| B.Ⅱ可表示爆炸反应 |
| C.Ⅲ可表示无催化剂(a)和有催化剂(b)时反应的能量变化 |
| D.Ⅳ可表示醋酸和碱的中和反应 |