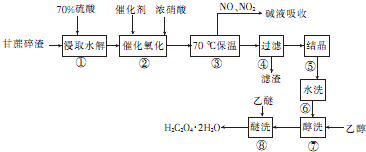
题目内容
3.下列离子方程式正确的是( )| A. | NaClO溶液中通入少量SO2:ClO-+SO2+H2O=2H++SO42-+Cl- | |
| B. | FeCl3溶液中通入过量H2S气体:2Fe3++3H2S=2FeS↓+S↓+6H+ | |
| C. | Na2CO3溶液中通入少量Cl2:2CO32-+Cl2+H2O=ClO-+Cl-+2HCO3- | |
| D. | NaHSO3溶液中通入少量Cl2:HSO3-+Cl2+H2O=3H++SO42-+2Cl- |
分析 A.发生氧化还原反应生成硫酸钠、氯化钠,碱性溶液中不能生成H+;
B.FeS溶于酸;
C.反应生成氯化钠、次氯酸钠、碳酸氢钠;
D.发生氧化还原反应,氯气不足还生成二氧化硫.
解答 解:A.NaClO溶液中通入少量的SO2的离子反应为ClO-+2OH-+SO2═Cl-+SO42-+H2O,故A错误;
B.FeCl3溶液中通入过量H2S气体的离子反应为2Fe3++H2S=2Fe2++S↓+2H+,故B错误;
C.Na2CO3溶液中通入少量Cl2的离子反应为2CO32-+Cl2+H2O=ClO-+Cl-+2HCO3-,故C正确;
D.NaHSO3溶液中通入少量Cl2的离子离子反应为4HSO3-+Cl2=3H2O+3SO2↑+SO42-+2Cl-,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应的离子反应考查,题目难度较大.

练习册系列答案
相关题目
13.把3molA和2.5molB混合盛入容积为2L的容器内,使它们发生反应:3A(气)+B(气)?xC(气)+2D(气)经过5min后达到平衡生成1mol D,测得C的平均生成速率为0.10mol•L-1•min-1.下列叙述正确的是( )
| A. | A的平均消耗速率为0.32mol•L-1•min-1 | |
| B. | B的转化率为80% | |
| C. | x的值为2 | |
| D. | B的平衡浓度为1mol•L-1 |
11.下列实验方案、现象和结论均正确的是( )
| A. |  向里推活塞时,长颈漏斗中有一段水柱,静止,水柱高度不变 该装置的气密性良好 向里推活塞时,长颈漏斗中有一段水柱,静止,水柱高度不变 该装置的气密性良好 | |
| B. |  脱脂棉燃烧 Na2O2与水反应生成氢氧化钠和氧气 脱脂棉燃烧 Na2O2与水反应生成氢氧化钠和氧气 | |
| C. |  烧杯①的澄清石灰水先变浑浊 NaHCO3比Na2CO3受热更易分解 烧杯①的澄清石灰水先变浑浊 NaHCO3比Na2CO3受热更易分解 | |
| D. |  U形管右端的液面高 铁钉发生吸氧腐蚀 U形管右端的液面高 铁钉发生吸氧腐蚀 |
18.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是( )
 ?
? ,△H=-4.2kJ.mol-1
,△H=-4.2kJ.mol-1
 (g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
(g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
 ?
? ,△H=-4.2kJ.mol-1
,△H=-4.2kJ.mol-1 (g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
(g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 |
15.下列各组离子,在强碱性溶液中可以大量共存的是( )
| A. | K+、Na+、H+、C1- | B. | Na+、Ba2+、Mg2+、NO3- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | K+、Na+、CO32-、S2- |
12.选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )
| A. | 不溶于水,且必须易与碘发生化学反应 | |
| B. | 不溶于水,不与碘发生化学反应且比水更易溶解碘 | |
| C. | 不溶于水,且必须比水密度大 | |
| D. | 不溶于水,且必须比水密度小 |
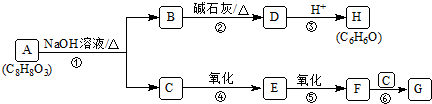
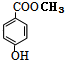 .
. .
.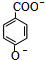 +CH3OH+H2O.
+CH3OH+H2O. ,该反应类型是缩聚.
,该反应类型是缩聚. .
.