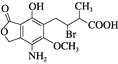
��Ŀ����
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺

(1)��Ũ������HCl�����ʵ���Ũ��Ϊ__________mol��L��1��
(2)ȡ����������ĸ�������Һʱ�������������в�����ȡ����Ķ��ٶ��仯����________(����ĸ)��
A����Һ��HCl�����ʵ���
B����Һ��Ũ��
C����Һ��Cl������Ŀ
D����Һ���ܶ�
(3)ijѧ����������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.400 mol��L��1��ϡ���ᡣ
�ٸ�ѧ����Ҫ��ȡ________mL����Ũ����������ơ�
�������ƹ����У�����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿(����������A��ʾ��ƫ��������B��ʾ��ƫС������C��ʾ����Ӱ����)��
a������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ����____��
b�����ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ��____��
(4)�ټ����ͬѧ�ɹ�������0.400 mol��L��1�����ᣬ�����ø������кͺ�0.4 g NaOH��NaOH��Һ�����ͬѧ��ȡ________mL���ᡣ
�ڼ����ͬѧ�������Ƶ������кͺ�0.4 g NaOH��NaOH��Һ�����ֱȢ����������ƫС������ܵ�ԭ����________��(����ĸ)
A��Ũ����ӷ���Ũ�Ȳ���
B��������Һʱ��δϴ���ձ�
C��������Һʱ����������ƿ�̶���
D����ˮʱ�����̶��ߣ��ý�ͷ�ι�����
���𰸡�11.9BD16.8BB25C
��������
��1������c=![]() ���㣻��2��ȡ����������ĸ�����ʱ����Һ��Ũ�ȡ���Һ���ܶȾ���������Ķ��ٶ��仯����3��������c1V1=c2V2����������500 mL���ʵ���Ũ��Ϊ0.400 mol��L��1��ϡ������ҪŨ����������������
���㣻��2��ȡ����������ĸ�����ʱ����Һ��Ũ�ȡ���Һ���ܶȾ���������Ķ��ٶ��仯����3��������c1V1=c2V2����������500 mL���ʵ���Ũ��Ϊ0.400 mol��L��1��ϡ������ҪŨ����������������![]() ����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ����(4)�ٸ��ݹ�ϵʽ
����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ����(4)�ٸ��ݹ�ϵʽ![]() �������������������� ����
�������������������� ����![]() ��������������ƫС��ԭ����
��������������ƫС��ԭ����
��1��c=![]() ����2��ȡ�����������Һʱ����Һ��Ũ�ȡ���Һ���ܶȾ���������Ķ��ٶ��仯������n=cv�����ʵ����ʵ���������йأ���BD��ȷ����3������������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.40 mol/L��ϡ���ᣬ����c1V1=c2V2�����Եõ�0.40��500=11.9��V2������V2=16.8mL���ڸ���
����2��ȡ�����������Һʱ����Һ��Ũ�ȡ���Һ���ܶȾ���������Ķ��ٶ��仯������n=cv�����ʵ����ʵ���������йأ���BD��ȷ����3������������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.40 mol/L��ϡ���ᣬ����c1V1=c2V2�����Եõ�0.40��500=11.9��V2������V2=16.8mL���ڸ���![]() ��a�����ӹ۲찼Һ����������ݱ��Լ��Ĵ��Լ���С�ˣ����������õ�ϡ��������ʵ���Ũ��ƫС��ѡB��b.���ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ����Һ���ƫ�������õ�ϡ��������ʵ���Ũ��ƫС��ѡB��(4)������Ҫ����������VmL��
��a�����ӹ۲찼Һ����������ݱ��Լ��Ĵ��Լ���С�ˣ����������õ�ϡ��������ʵ���Ũ��ƫС��ѡB��b.���ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ����Һ���ƫ�������õ�ϡ��������ʵ���Ũ��ƫС��ѡB��(4)������Ҫ����������VmL��
���ݹ�ϵʽ

V=0.025L=25mL��
�� ����![]() ��A��Ũ����ӷ���Ũ��ƫС����
��A��Ũ����ӷ���Ũ��ƫС����![]() ƫ������A���� B��������Һʱ��δϴ���ձ�������Ũ��ƫС����
ƫ������A���� B��������Һʱ��δϴ���ձ�������Ũ��ƫС����![]() ƫ������B���� C��������Һʱ����������ƿ�̶��ߣ�����Ũ��ƫ����
ƫ������B���� C��������Һʱ����������ƿ�̶��ߣ�����Ũ��ƫ����![]() ƫС����C��ȷ�� D����ˮʱ�����̶��ߣ��ý�ͷ�ι�����������Ũ��ƫС����
ƫС����C��ȷ�� D����ˮʱ�����̶��ߣ��ý�ͷ�ι�����������Ũ��ƫС����![]() ƫ������D����
ƫ������D����

 53���ò�ϵ�д�
53���ò�ϵ�д�����Ŀ���Ҵ�����Ҫ�Ļ���ԭ�Ϻ�Һ��ȼ�ϣ������������з�Ӧ��ȡ�Ҵ���2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g)
CH3CH2OH(g) + 3H2O(g)
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��_________________________��
��2����˵����CO2Ϊԭ�Ϻϳ��Ҵ����ŵ���_____________________��ֻҪ��д��һ������
��3����һ��ѹǿ�£���ø÷�Ӧ��ʵ���������±���
| 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
�� �÷�Ӧ��___________��Ӧ������ȡ����ȡ�����
�� һ�����������������̼��[n(H2)/n(CO2)]����CO2��ת����______________�����������С�������䡱��
��4��һ���Ҵ�ȼ�ϵ���з����Ļ�ѧ��ӦΪ����������Һ���Ҵ�������������ˮ�Ͷ���
��̼���õ�صĸ�����ӦʽΪ��_______________________________________��
��5��25����101 kPa�£�H2(g)��C2H4(g)��C2H5OH(l)��ȼ���ȷֱ���285.8 kJ �� mol��1��1411.0 kJ �� mol��1��1366.8 kJ �� mol��1����д����C2H4(g)��H2O(l)��Ӧ����C2H5OH(l)���Ȼ�ѧ����ʽ____________________________________________________��
����Ŀ���������Ϊ5 mL�ļס��ҡ�������Һ���������Թܱڻ��������Թ���(����)��������ͼ��ʾ��ʵ��������ס��ҡ�������Ͽ�����(����)
![]()
ѡ�� | A | B | C | D |
�� | 1,2�������� | �屽 | ˮ | �Ҵ� |
�� | ˮ | Һ�� | ���� | ���� |
�� | �� | �Ҵ� | ��ˮ | �������� |
A. A B. B C. C D. D
����Ŀ���۲����б���ģ�ͣ�ÿ��ģ�ͱ�ʾ�ķ��Ӿ���C��H��O�е����ֻ����ֹ��ɡ��Ը�ģ�ͱ�ʾ�����ʵ����������ȷ����(����)
����ģ�� | ��ģ�ͱ�ʾ�����ʵ�������� | |
A |
| ����״����С����ͬ�Ľ����Ʒֱ�Ͷ��ʢ��0.1 mol/L�ĸ����ʵ�ˮ��Һ����ˮ�Ҵ���ˮ���ձ��У�ʢ�����ʵ��ձ��в������ݵ��������� |
B |
| �����ȵ�ͭ˿��������ʢ�и����ʵ��Թ��У��۲쵽ͭ˿�ɺ�ɫ��Ϊ�����ĺ�ɫ�������д̼�����ζ�����ʡ��˷�Ӧ�����˸����ʵ������� |
C |
| �ڷ�Һ©���м�����������ˮ�Ļ��Һ���������ˮ��ɫ����ʱ������ȡ����Ӧ |
D |
| �����ʼ���̼ԭ����С��10��ͬϵ���У�һ�ȴ���ֻ��һ��(�����������칹)�����ʹ���4�� |
A. A B. B C. C D. D