题目内容
【题目】(1)白色固体PCl5受热即挥发并发生分解:PCl5(g) ![]() PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为________。
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为________。
(2)下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO![]() >I-,氧化性IO
>I-,氧化性IO![]() >I2>SO
>I2>SO![]() 。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为________mol。
。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为________mol。

(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为:_____________________,该过程中被氧化的元素是 ___________,当产生标准状况下2.24L![]() 时,共转移电子_______mol。
时,共转移电子_______mol。
【答案】 78.6% 3 6NH3+5CH3OH+12O2=3N2+5CO2+19H2O C、N 0.96
【解析】试题分析:(1)利用“三段式”计算;(2)根据氧化性强弱和图像可知c点的还原产物是0.6mol I2,氧化产物是SO![]() ,反应方程式为
,反应方程式为![]() ,根据方程式计算NaHSO3物质的量;(3) 用氨(NH3)处理含甲醇(CH3OH)的工业废水,氨气被氧化为氮气,甲醇被氧化为二氧化碳,方程式为6NH3+5CH3OH+12O2=3N2+5CO2+19H2O,根据方程式计算转移电子的量。
,根据方程式计算NaHSO3物质的量;(3) 用氨(NH3)处理含甲醇(CH3OH)的工业废水,氨气被氧化为氮气,甲醇被氧化为二氧化碳,方程式为6NH3+5CH3OH+12O2=3N2+5CO2+19H2O,根据方程式计算转移电子的量。
解析:5.84 g PCl5的物质的量是![]() ,
,
0.028-x+ x + x =0.05
X=0.022
平衡时PCl5的分解率为![]()
(2)设NaHSO3物质的量为x mol,
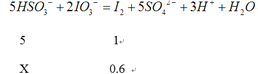
X=3
(3)氨(NH3)处理含甲醇(CH3OH)的工业废水,变成无毒的CO2和N2,化学方程式为
6NH3+5CH3OH+12O2=3N2+5CO2+19H2O,反应中C、N元素化合价升高被氧化,根据方程式,生成5mol CO2转移电子48mol,所以当产生标准状况下2.24L![]() 时,共转移电子0.96mol.
时,共转移电子0.96mol.




