题目内容
以下是对金属及其化合物的讨论,根据要求回答问题
(1)写出钠与水反应的离子方程式 。
(2)在AlCl3溶液中逐滴滴入过量的NaOH溶液,观察到的现象是 ,
反应的离子方程式为 , 。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为 。
(1)2Na+2H2O=2Na++2OH-+H2↑ (2)先沉淀后溶解,Al3++3OH-=3Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O (3)1:1
【解析】
试题分析:(1)书写离子方程式时,只能将强电解质(指溶于水中的强电解质)写出离子形式,其它(包括难溶强电解质)一律写成分子形式。则得出离子方程式为2Na+2H2O=2Na++2OH-+H2↑。(2)在AlCl3溶液中逐滴滴入NaOH溶液,先发生AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成白色的Al(OH)3沉淀,随着NaOH溶液滴加过量,则生成的Al(OH)3与过量的NaOH反应生成NaAlO2,反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,沉淀又溶解。根据离子方程式书写规则得反应的离子方程式为Al3++3OH-=3Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O (3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,而Al反应产生H2实质上是电子的转移,Al失电子,H+得电子变为H2,在相同状况下产生氢气的量相同,则由得失电子守恒知,消耗铝的物质的量也相同,因此,两个反应中消耗的铝的物质的量之比为1:1。
考点:考查离子方程式的书写以及得失电子守恒原理。

 阅读快车系列答案
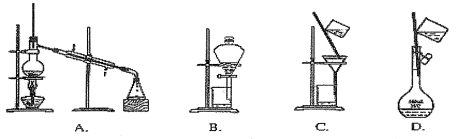
阅读快车系列答案TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,与氢气的相对分子质量之比为120。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。其主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
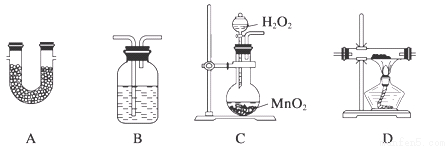
(1)将所选用的仪器(可重复选用)连接顺序由上到下依次填入下表,并写出该仪器中应加入的试剂的名称及作用。
选用的仪器 | 加入试剂 | 加入试剂的作用 |
C | H2O2溶液与MnO2 | 产生氧气 |
|
|
|
|
|
|
D | CuO粉末 | 将可能生成的CO转化为CO2 |
|
|
|
|
|
|
|
|
|
(2)实验后称得A及以后的装置(均用A装置并假设每次吸收均是完全的)质量依次增加3.60 g、14.08 g、0.14 g,则TMB的分子式为__________________________。