题目内容
【题目】环戊二烯(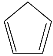 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)
(g) ![]()
![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g)
(g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g) ![]() 2HI(g) ΔH2=11.0 kJ·mol 1②,对于反应:
2HI(g) ΔH2=11.0 kJ·mol 1②,对于反应:![]() (g)+ I2(g)
(g)+ I2(g) ![]()
![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
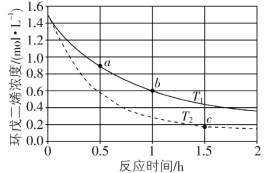
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
【答案】89.3 40% 3.56×104 BD CD
【解析】
(1)利用盖斯定律解题;
(2)利用差量法计算转化率;三行式法计算平衡常数;根据平衡移动原理解释;
(3)通过外界因素对速率的影响和平衡状态的形成分析A、B、C选项,D选项观察图象计算;
(1)已知:![]() (g)=
(g)=![]() (g)+H2(g)△H1=+100.3kJmol-1 ①,H2(g)+I2(g)=2HI(g)△H2=-11.0kJmol-1②,根据盖斯定律,①+②得③
(g)+H2(g)△H1=+100.3kJmol-1 ①,H2(g)+I2(g)=2HI(g)△H2=-11.0kJmol-1②,根据盖斯定律,①+②得③![]() (g)+I2(g)=
(g)+I2(g)=![]() (g)+2HI(g)△H3=(+100.3kJmol-1)+(-11.0kJmol-1)=+89.3kJmol-1;
(g)+2HI(g)△H3=(+100.3kJmol-1)+(-11.0kJmol-1)=+89.3kJmol-1;
(2)设碘和环戊烯(![]() )的初始物质的量都为nmol,转化的物质的量为xmol,
)的初始物质的量都为nmol,转化的物质的量为xmol,
![]() (g)+I2(g)=
(g)+I2(g)=![]() (g)+2HI(g)
(g)+2HI(g)
初始(mol) n n 0 0
转化(mol)x x x 2x
平衡(mol)n-x n-x x 2x
刚性容器内气体的压强与物质的量成正比,则:![]() =1+20%,解得:x=0.4n,
=1+20%,解得:x=0.4n,
平衡时环戊烯的转化率为:![]() ×100%=40%;
×100%=40%;
平衡时混合气体的压强为:105Pa×(1+20%)=1.2×105Pa,混合气体总物质的量为:(n-0.4n+n-0.4n+0.4n+0.4n×2)mol=2.4nmol,
平衡时各组分所占压强分别为p(![]() )=p(I2)=
)=p(I2)=![]() ×1.2×105Pa=3×104Pa,p(
×1.2×105Pa=3×104Pa,p(![]() )=
)=![]() ×1.2×105Pa=2×104Pa,p(HI)=
×1.2×105Pa=2×104Pa,p(HI)=![]() ×1.2×105Pa=4×104Pa,该反应的平衡常数Kp=
×1.2×105Pa=4×104Pa,该反应的平衡常数Kp=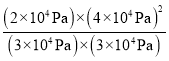 ≈3.56×104Pa;
≈3.56×104Pa;
A.通入惰性气体,各组分浓度不变,平衡不移动,则环戊烯的转化率不变,故A错误;
B.该反应为吸热反应,提高温度平衡向着正向移动,环戊烯的转化率增大,故B正确;
C.增加环戊烯浓度,环戊烯的转化率减小,故C错误;
D.增加碘浓度,反应物浓度增大,平衡向着正向移动,环戊烯的转化率增大,故D正确;
故答案为BD;
(3)A.温度越高反应速率越快,根据图示可知,在温度T2(虚线)的反应速率较大,则T1<T2,故A错误;
B.根据图象可知,a点切线斜率的绝对值大于c点切线的绝对值,则a点速率大于c点,故B错误;
C.a到b的过程为正反应速率逐渐减小,且b点v(正)>v(逆),则a点的正反应速率大于b点的逆反应速率,故C正确;
D.b点时环戊二烯的浓度变化为:1.5mol/L-0.6mol/L=0.9mol/L,环戊二烯的二聚体的浓度为环戊二烯浓度变化的![]() ,则b点时二聚体的浓度为0.9mol/L×
,则b点时二聚体的浓度为0.9mol/L×![]() =0.45molL-1,故D正确;
=0.45molL-1,故D正确;
故答案为CD。