题目内容
【题目】碳和硫单质及其化合物在工农业生产中有着重要的应用,CO2的过渡排放会导致温室效应,而SO2 直接排放会对环境造成危害。
I.有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
① 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △Hl=-76.0kJ/mol
② C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+113.4kJ/mol
则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=_______。
II. SO2的尾气处理通常有以下几种方法:
(l)活性炭还原法
反应原理:恒温恒容时,2C(s)+2SO2(g)===S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度如图:

①0~20min反应速率表示为v(SO2)=_________;
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③4Omin时,平衡常数K=__________。
(2)亚硫酸钠吸收法
① Na2SO4溶液吸收SO2的化学方程式为______________;
② 常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定不正确的是_____(填序号)。
a. c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b. c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c. c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.水电离出c(H+)=1×10-5mol/L
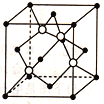
(3)电化学处理法

① 如图所示,Pt(II)电极的反应式为__________;
② 当电路中转移0.04mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加____mol离子。
【答案】 +18.7kJ/mol 0.03mol/(L·min) 减小CO2的浓度 0.675 Na2SO3+SO2+H2O=2NaHSO3 d 2HSO![]() +2e-+2H+=S2O
+2e-+2H+=S2O![]() +2H2O 0.06
+2H2O 0.06
【解析】(1)由盖斯定律:此反应△H=(①+②)÷2=(76.0kJ/mol+113.4kJ/mol)= +18.7kJ/mol;
II. ①0~20min时,SO2浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,则反应速率表示为V(SO2)==0.03mol/(L·min),故答案为:0.03mol/(L·min);②30min时,CO2浓度减小,其他物质浓度不变,改变的条件是减小CO2的浓度,③40min时平衡常数和20min时相同,20min时,SO2(g)=0.4mol/L,S2(g)=0.3mol/L,CO2(g)=0.6mol/L,则平衡常数K=(0.3×0.62)/0.42=0.675。
(2)亚硫酸钠吸收法, ① Na2SO4溶液吸收SO2达最大量时的化学方程式为Na2SO3+SO2+H2O=2NaHSO3 ;② 常温下,当吸收至NaHSO3时,电离大于水解,溶液呈酸性,a. c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)正确,b. (Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)电荷守恒正确,又HSO3—的电离大于水解,c. c(Na+)>c(HSO3-)>c(H+)>c(SO32-)正确,d.水电离出c(H+)肯定小于1×10-7mol/L,d错误。
(3)电化学处理法,① Pt(II)电极上发生还原反应,酸性介质,其反应式为:2HSO![]() +2e-+2H+=S2O
+2e-+2H+=S2O![]() +2H2O; ②当电路中0.04mole-时(较浓H2SO4尚未排出),由SO2+2H2O-2e-═SO42-+4H+,则交换膜左侧溶液中约增加0.06mol离子,故答案为:0.06。
+2H2O; ②当电路中0.04mole-时(较浓H2SO4尚未排出),由SO2+2H2O-2e-═SO42-+4H+,则交换膜左侧溶液中约增加0.06mol离子,故答案为:0.06。

【题目】下列各组物质依次满足如图所示直接转化关系的是
a | b | c | d | |
1 | Si | SiO2 | H2SiO3 | Na2SiO3 |
2 | S | SO2 | H2SO3 | H2SO4 |
3 | Na | NaOH | Na2CO3 | NaHCO3 |
4 | Fe | FeCl2 | Fe(OH)2 | Fe(OH)3 |
5 | Mg | MgO | Mg(OH)2 | MgSO4 |
6 | Al | Al2O3 | Al(OH)3 | NaAlO2 |
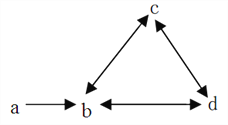
A. ①②③⑥ B. ②③ C. ②③⑥ D. ②③④⑤
【题目】一篇名为《最终我坐着轮椅被推出了首都国际机场》的文章在网络上引发超过10万次点击。文中女留学在国外吸食笑气导致身体机能全面紊乱,坐轮椅回国。笑气成分是N2O,可作奶油发泡剂,但长期或大剂量滥用会导致神经及脊髓病变。一定条件下,N2O分解的部分实验数据如下表:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
下图能正确表示该反应有关物理量变化规律的是
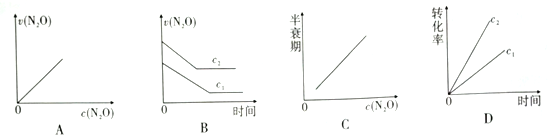
A. A B. B C. C D. D