题目内容
反应N2O4(g)  ?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )
?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )
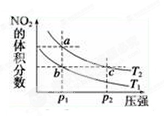
 ?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )
?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深,c浅 |
| C.b、c两点的平衡常数:b<c |
| D.a、c两点气体的平均相对分子质量:a>c |
C
试题分析:反应N2O4(g)
 2NO2(g) ΔH=+57 kJ/mol的正反应是气体体积增大的吸热反应。根据平衡移动原理可知:若要使平衡混合物中NO2的体积分数增大,可以采用减小压强或升高温度的方法。A.a、c两点温度相同。而压强c>a.由于增大压强,物质的浓度增大,所以化学反应速率加快,因此a、c的反应速率:c > a.错误。B.由于压强c > a,压强越大,单位体积内的物质越多,浓度越大。因此a、c两点气体的颜色:a浅c深.错误。C.由题图可在:在相同压强下,温度为T2时平衡混合物中NO2的体积分数比T1大。说明温度T2 >T1。即温度c >b。升高温度化学平衡正向移动,所以化学平衡常数增大。因此b、c两点的平衡常数:b<c。正确。D.由于压强c>a。增大压强,化学平衡向气体体积减小的反应,即向逆反应方向移动。气体的物质的量减小,单位物质的量的气体的质量增大。因此a、c两点气体的平均相对分子质量:c > a.错误。
2NO2(g) ΔH=+57 kJ/mol的正反应是气体体积增大的吸热反应。根据平衡移动原理可知:若要使平衡混合物中NO2的体积分数增大,可以采用减小压强或升高温度的方法。A.a、c两点温度相同。而压强c>a.由于增大压强,物质的浓度增大,所以化学反应速率加快,因此a、c的反应速率:c > a.错误。B.由于压强c > a,压强越大,单位体积内的物质越多,浓度越大。因此a、c两点气体的颜色:a浅c深.错误。C.由题图可在:在相同压强下,温度为T2时平衡混合物中NO2的体积分数比T1大。说明温度T2 >T1。即温度c >b。升高温度化学平衡正向移动,所以化学平衡常数增大。因此b、c两点的平衡常数:b<c。正确。D.由于压强c>a。增大压强,化学平衡向气体体积减小的反应,即向逆反应方向移动。气体的物质的量减小,单位物质的量的气体的质量增大。因此a、c两点气体的平均相对分子质量:c > a.错误。
练习册系列答案
相关题目
 2HI(g)在密闭容器中反应,达到平衡状态时的标志是( )
2HI(g)在密闭容器中反应,达到平衡状态时的标志是( )  4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是
4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是 CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
 CO2(g)+H2(g)ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g)ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
 N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则: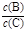 将 。
将 。