题目内容
【题目】1,2—二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用如图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,用于制备乙烯,试管d中装有液溴(表面覆盖少量水)。下列有关说法不正确的是( )
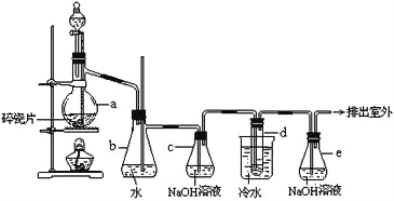
A.实验中为了防止有机物大量挥发,应迅速升高反应温度至170℃
B.装置c和装置e中都盛有NaOH溶液,其吸收的杂质不相同
C.制备乙烯和生成1,2—二溴乙烷的反应类型分别是消去反应和加成反应
D.向d中产物加入饱和Na2CO3溶液震荡静置,可用分液的方法进行分离
【答案】A
【解析】
制备1,2-二溴乙烷,由实验装置可知,分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,反应生成乙烯;乙醇易挥发,且极易溶于水,所以b可吸收乙醇,并可防止倒吸,导管可以平衡压强,防止体系压强过高;c中NaOH溶液可除去乙烯中混有的酸性物质,d中发生乙烯和溴发生加成反应制备1,2-二溴乙烷,e可吸收尾气中挥发的溴,以此来解答。
A.迅速升高反应温度至170℃是为了减少副反应的发生,并不能防止有机物的挥发,故A错误;
B.装置c中NaOH溶液主要吸收浓硫酸和乙醇反应过程中产生的酸性气体(主要为二氧化硫、二氧化碳),装置e主要吸收挥发出的溴,故B正确;
C.乙醇发生消去反应生成乙烯,乙烯和溴发生加成反应生成1,2-二溴乙烷,故C正确;
D.d中产品主要为1,2-二溴乙烷,加入饱和Na2CO3溶液震荡静置,可以除去未反应的溴,产品不溶于水,溶液会分层,可分液分离,故D正确;
故答案为A。

 优学名师名题系列答案
优学名师名题系列答案【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变