题目内容
【题目】Ag2CrO4在水中的沉淀溶解平衡曲线如图所示,t℃时,反应Ag2CrO4(s)+2Cl﹣(aq)=2AgCl(s)+CrO42﹣(aq)的K=2.5×107 , 下列说法正确的是( )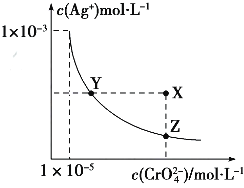
A.t℃时,Ag2CrO4的Ksp为1×10﹣12
B.t℃时,向饱和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡时c2(Ag+)×c(CrO42﹣)>Ksp
C.t℃时,Ksp(AgCl)=1.56×10﹣10
D.t℃时,用0.01molL﹣1 AgNO3溶液滴定20mL 0.01molL﹣1KCl和0.01mol K2CrO4的混合溶液,CrO42﹣先沉淀
【答案】A
【解析】A、依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s) ![]() 2Ag+CrO42﹣ ,
2Ag+CrO42﹣ ,
Ksp=c2(Ag+)c(CrO42﹣)=(10﹣3)2×10﹣6=10﹣12 , 所以A正确;
B、溶度积常数只与温度有关,温度不变,溶度积常数不变,所以B错误;
C、Ag2CrO4(s)+2Cl﹣(aq)2AgCl(s)+CrO42﹣(aq)的K=![]()
![]() =2.5×107 , 解Ksp(AgCl)=
=2.5×107 , 解Ksp(AgCl)= ![]() =2×10﹣10 , 所以C错误;
=2×10﹣10 , 所以C错误;
D、依据溶度积常数计算Ksp(CrO42﹣)=c2(Ag+)c(CrO42﹣)=1×10﹣12;Ksp(AgCl)=c(Ag+)×c(Cl﹣)=2×10﹣10 , 以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42﹣)=0.01mol/L,得到c(Ag+)= ![]() =1×10﹣5mol/L;0.01mol/L KCl溶液中,c(Cl﹣)=0.01mol/L;依据溶度积计算得到:c(Ag+)=
=1×10﹣5mol/L;0.01mol/L KCl溶液中,c(Cl﹣)=0.01mol/L;依据溶度积计算得到:c(Ag+)= ![]() =2×10﹣8mol/L;所以先析出氯化银沉淀,所以D错误,所以选A.
=2×10﹣8mol/L;所以先析出氯化银沉淀,所以D错误,所以选A.

【题目】为了提纯下列物质(括号内为杂质R所选用的除杂试剂与除杂方法都正确的是
不纯物 | 除杂试剂 | 除杂方法 | |
A. | 乙烷(乙烯) | H2 | Ni/加热 |
B. | 乙醇(水) | CuSO4 | 蒸馏 |
C. | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
D. | 乙酸(水) | Na | 蒸馏 |
A. A B. B C. C D. D






