题目内容
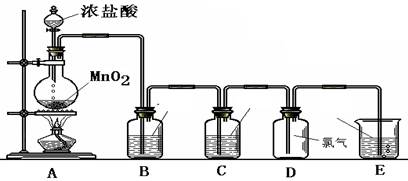
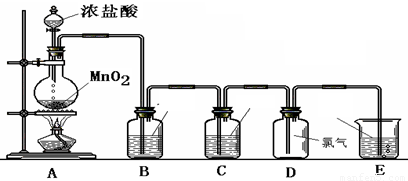
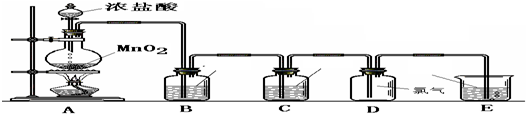
某小组准备在实验室中制取干燥、纯净的氯气并验证氯气的性质,设计了如下的实验装置图:
(一) 制取纯净的氯气

(1)写出A中反应的化学方程式:
(2)B中加入的物质是:
(3)C中加入的物质是:
(4)E中反应方程式为:
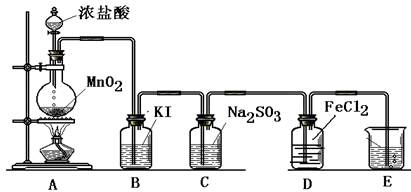
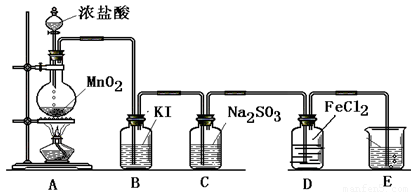
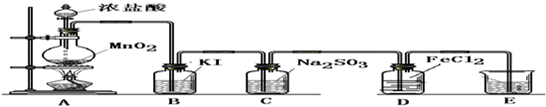
(二) 验证氯气的性质:
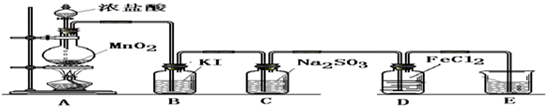
(1)B中发生反应的方程式为:
(2)C中发生反应的方程式为:
(3)D中的反应方程式为:
(一) 制取纯净的氯气

(1)写出A中反应的化学方程式:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2)B中加入的物质是:
饱和食盐水
饱和食盐水
作用是:除去Cl2中混有的HCl气体
除去Cl2中混有的HCl气体
.(3)C中加入的物质是:
浓硫酸
浓硫酸
作用是:干燥Cl2
干燥Cl2
.(4)E中反应方程式为:
2NaOH+Cl2 =NaCl+NaClO+H2O
2NaOH+Cl2 =NaCl+NaClO+H2O
.(二) 验证氯气的性质:

(1)B中发生反应的方程式为:
Cl2+2KI=2KCl+I2
Cl2+2KI=2KCl+I2
.(2)C中发生反应的方程式为:
Cl2+Na2SO3+H2O=Na2SO4+2HCl
Cl2+Na2SO3+H2O=Na2SO4+2HCl
.(3)D中的反应方程式为:
2FeCl2+Cl2=2FeCl3
2FeCl2+Cl2=2FeCl3
.分析:(一)(1)根据浓盐酸和二氧化锰的性质判断生成物,从而写出反应方程式;
(2)根据混合气体的成分及氯气、氯化氢的性质分析;
(3)根据杂质的成分及性质分析;
(4)根据氯气的性质分析;
(二)根据氯气的性质分析.
(2)根据混合气体的成分及氯气、氯化氢的性质分析;
(3)根据杂质的成分及性质分析;
(4)根据氯气的性质分析;
(二)根据氯气的性质分析.
解答:解:(一)(1)浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水.
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)浓盐酸有挥发性,浓盐酸中的水在加热条件下变成水蒸气,所以氯气中混有氯化氢和水蒸气;氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和的食盐水除去HCl气体.
故答案为:饱和食盐水;除去Cl2中混有的HCl气体;
(3)浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气;
故答案为:浓硫酸;干燥氯气;
(4)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气.
故答案为:2NaOH+Cl2 =NaCl+NaClO+H2O;
(二)(1)氯气有氧化性,能置换出碘化钾中的碘,故答案为:Cl2+2KI=2KCl+I2;
(2)氯气有氧化性,能把亚硫酸钠中的硫元素氧化成最高价,本身被还原成-1价,故答案为:Cl2+Na2SO3+H2O=Na2SO4+2HCl;
(3)氯气有氧化性,能把变价金属离子氧化成最高价,本身被还原成-1价,故答案为:2FeCl2+Cl2=2FeCl3.
故答案为:MnO2+4HCl(浓)
| ||
(2)浓盐酸有挥发性,浓盐酸中的水在加热条件下变成水蒸气,所以氯气中混有氯化氢和水蒸气;氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和的食盐水除去HCl气体.
故答案为:饱和食盐水;除去Cl2中混有的HCl气体;
(3)浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气;
故答案为:浓硫酸;干燥氯气;
(4)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气.
故答案为:2NaOH+Cl2 =NaCl+NaClO+H2O;
(二)(1)氯气有氧化性,能置换出碘化钾中的碘,故答案为:Cl2+2KI=2KCl+I2;
(2)氯气有氧化性,能把亚硫酸钠中的硫元素氧化成最高价,本身被还原成-1价,故答案为:Cl2+Na2SO3+H2O=Na2SO4+2HCl;
(3)氯气有氧化性,能把变价金属离子氧化成最高价,本身被还原成-1价,故答案为:2FeCl2+Cl2=2FeCl3.
点评:注意以下几点:
1、氯气有强氧化性,能把变价金属离子氧化成最高价;
2、浓盐酸和二氧化锰能反应,但稀盐酸和二氧化锰不反应;
3、次氯酸是弱酸,但次氯酸具有强氧化性.
1、氯气有强氧化性,能把变价金属离子氧化成最高价;
2、浓盐酸和二氧化锰能反应,但稀盐酸和二氧化锰不反应;
3、次氯酸是弱酸,但次氯酸具有强氧化性.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目