题目内容
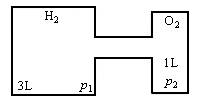
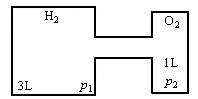
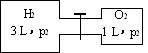
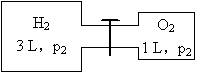
在10℃时,有体积为3 L和1 L的容器,如图所示.图中左、右两容器内分别充入氢气和氧气,压力各为p1和p2.开启阀门,点燃,反应后将气体冷却至原温度.计算:
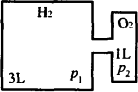
(1)在10℃时反应前在p1下氧气的体积为多少?
(2)在10℃时反应后容器内的压强p的值为多少?
答案:利用方程式计算
解析:
解析:
|
(1)因为温度不变,气体物质的量没变,根据玻意耳定律: p1V1=p2V2,代入V2=1 L 所以V1= (2)在10℃,p1条件下,H2∶3 L O2∶ ①若H2过量:2H2 + O2 2 1 则剩余H2∶ p1· ②若O2过量,则剩余O2为 ③若H2、O2恰好反应,则未剩余气体,压强p=0. |

练习册系列答案
相关题目
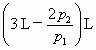 ,因为反应后只有H2体积为4 L,根据玻意耳定律:
,因为反应后只有H2体积为4 L,根据玻意耳定律: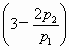 =p·4 解得p=
=p·4 解得p=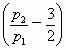 L.反应后剩余O2充满4 L空间,则根据玻意耳定律有:p1·
L.反应后剩余O2充满4 L空间,则根据玻意耳定律有:p1·