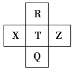
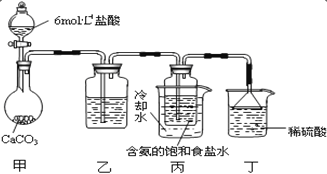
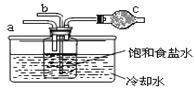
题目内容
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________;
②Fe的基态原子共有______种不同能级的电子;
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_______;
②COCl2分子中σ键和π键的个数比为______,中心原子的杂化方式为_______;
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm,则熔点:NiO____(填“>”、“<”或“=”)FeO;
(4)铁的某种单质的晶胞为面心立方结构,原子的配位数为_______,若铁原子半径为a nm,则该单质的密度为_______g/cm3。
【答案】3d24s2 7 O>Cl>C 3:1 sp2 > 12 ![]()
【解析】
(1)①Ti是22号元素,其基态原子价电子排布式为3d24s2;
②Fe是26号元素,原子核外电子排布式为1s22s22p63s23p63d64s2,因此基态原子共有7种不同能级的电子;
(2)①非金属性越强,电负性越大,因此上述化学方程式中非金属元素电负性由大到小的顺序是O>Cl>C;
②COCl2分子的结构式为![]() ,单键都是σ键,双键中含有1个σ键和1个π键,则分子中σ键和π键的个数比为3:1;碳原子形成3个σ键,没有孤对电子,所以分子中中心原子的杂化方式为sp2;
,单键都是σ键,双键中含有1个σ键和1个π键,则分子中σ键和π键的个数比为3:1;碳原子形成3个σ键,没有孤对电子,所以分子中中心原子的杂化方式为sp2;
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,均属于离子晶体,离子所带电荷数相同,其中Ni2+离子半径小于Fe2+离子半径,因此NiO的晶格能大于FeO的晶格能,则熔点:NiO>FeO。
(4)铁的某种单质的晶胞为面心立方结构,因此原子的配位数为12;若铁原子半径为a nm,则晶胞面对角线是4a nm,因此晶胞棱长是![]() ,晶胞中含有铁原子的个数是8×
,晶胞中含有铁原子的个数是8×![]() +6×
+6×![]() =4,因此该单质的密度为
=4,因此该单质的密度为![]() g/cm3。
g/cm3。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) | |
起始时 | 3 | 3 | 0 |
2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1