题目内容
【题目】海水中含有非常丰富的化学资源,从海水中可提取多种化工原料。下图是某工厂对海水资源综合利用的示意图。
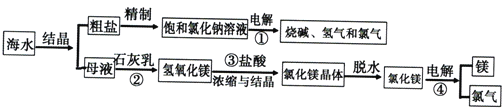
试回答下列问题:
(1)反应①、②、③、④中,属于氧化还原反应的是__________。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,有人设计如下方案:先将粗盐溶于水,再加入过量的氢氧化钠溶液,然后进行下列四项操作:a.过滤;b.加适量的盐酸;c.加过量的碳酸钠溶液;d.加过量的氯化钡溶液,该四项合理的操作顺序为______(每个操作仅用一次,用a、b、c、d符号填写)
(3)请写出反应①的化学方程式_______________。
(4)请写出反应③的离子方程式_______________。
(5)母液中通入氯气,还可以制备溴单质,该反应的离子方程式为____________。
【答案】 ①④ dcab 2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH Mg(OH)2 +2H+ =Mg2+ +2H2O Cl2+2Br-=2Cl-+Br2
H2↑+Cl2↑+2NaOH Mg(OH)2 +2H+ =Mg2+ +2H2O Cl2+2Br-=2Cl-+Br2
【解析】(1).①④两个反应中有元素的化合价发生了变化,②③两个反应是复分解反应,化合价不发生变化,所以填①④。
(2). 加入过量氢氧化钠溶液时将Mg2+完全沉淀了,沉淀SO42-需要氯化钡溶液,过量的氯化钡还需要用碳酸钠除去,所以要先加氯化钡溶液后加碳酸钠溶液,过滤后,向滤液中加入适量盐酸除去过量的氢氧化钠和碳酸钠。所以填dcab。
(3). 2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH。
H2↑+Cl2↑+2NaOH。
(4). Mg(OH)2 +2H+ =Mg2+ +2H2O。
(5). Cl2+2Br-=2Cl-+Br2。

练习册系列答案
相关题目