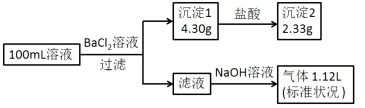
题目内容
【题目】金属在现代社会中发挥着巨大的作用,铝的化合物在工农业生产及人们的日常生活中也具有广泛地作用。
(1)若将铝溶解,下列试剂中最好选用________(填选项字母)。
A.浓硫酸B.稀硫酸C.稀硝酸
(2)以铝土矿(主要成分是Al2O3,杂质有SiO2、Fe2O3等)为原料,采用拜耳法生产Al2O3的流程如下图所示:
①Al2O3可用于电解制Al,电解时需加入冰晶石(Na3AlF6)作为助熔剂,用NaF和Al2(SO4)3反应制备冰晶石的化学方程式为________________;电解时用石墨作阳极,温度维持在950~970℃,阳极需定期更换,其原因为________________________。
②赤泥中铝硅酸钠的化学式可表示为:3Na2O·3Al2O3·5SiO2·5H2O,则滤液I的主要成分是________________;铝土矿的品位常用铝硅比(A/S,即矿石中Al2O3与SiO2的质量比)来衡量。某种铝土矿的A/S=10.2,则加入足量NaOH溶液后铝的理论溶出率为________________。
③该生产过程中,需向沉淀池中加入过量的X,该反应的离子方程式为________________。
(3)铍(Be)与铝元素相似,其氧化物及氢氧化物具有两性,请写出BeO与盐酸反应的离子方程式,Be(OH)2溶于NaOH溶液的化学方程式为:Be(OH)2+2NaOH=Na2BeO2+2H2O,往10.0mL1.00mol·L-1的Be(NO3)2溶液中逐滴加入等浓度的NaOH溶液,请在以下坐标图中画出沉淀量随NaOH溶液加入量的变化图:

【答案】(1)B
(2)①12NaF+Al2(SO4)3=2Na3AlF6+3Na2SO4;阳极产生的O2与石墨反应
②NaAlO2(多写NaOH也可)90%
③AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-
(3)BeO+2H+=Be2++H2O;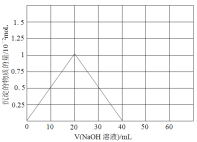
【解析】
试题分析:(1)A、C中浓硫酸、硝酸与Al反应生成有毒气体,只有B溶解Al最好,故答案为:B;
(2)①NaF和Al2(SO4)3反应可生成Na3AlF6和Na2SO4,方程式为12NaF+Al2(SO4)3=2Na3AlF6+3Na2SO4,电解时用石墨作阳极,温度维持在950~970℃,阳极产生的O2与石墨反应,因此阳极需定期更换,故答案为:12NaF+Al2(SO4)3═2Na3AlF6+3Na2SO4;阳极产生的O2与石墨反应;
②氧化铝可与氢氧化钠溶液反应生成偏铝酸钠,则溶出液的溶质主要是偏铝酸钠;由矿渣的化学式3Na2O3Al2O35SiO25H2O知,其中的n(Al2O3):n(SiO2)=3:5,故有30-3=27份的Al2O3被溶解,即Al2O3溶出,转化率为90%;故答案为:NaAlO2;90%;
③将偏铝酸钠沉淀,可以向沉淀池中通入过量的二氧化碳,反应的离子方程式为,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)BeO与盐酸反应的生成氯化铍和水,反应的离子方程式为:BeO+2H+=Be2++H2O;Be(NO3)2溶液中逐滴加入等浓度的NaOH先后发生反应:Be(NO3)2+2NaOH=Be(OH)2↓+2NaNO3,Be(OH)2+2NaOH═Na2BeO2+2H2O,先产生沉淀,然后沉淀消失,两次消耗的氢氧化钠的物质的量都为0.02mol(即20mLNaOH溶液),产生的Be(OH)2沉淀为0.01mol,沉淀量随NaOH溶液加入量的变化图为: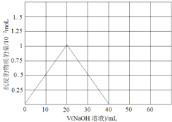 ;故答案为:BeO+2H+=Be2++H2O;
;故答案为:BeO+2H+=Be2++H2O;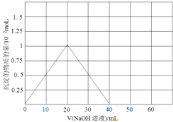 。
。