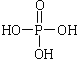
题目内容
【题目】本题为《化学反应原理(选修4)》选做题。
(l)T℃时,在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C的浓度随时间t的变化如图所示。

该反应的化学方程式为____________。在2分钟内用A的浓度变化表示的平均反应速率为___________mol·L一l·min一l。
(2)一定条件下,上述反应达到化学平衡状态的标志是_____(填字母代号)。
A.v(正)=v(逆)=0
B.各物质的浓度不再变化
C.单位时间内消耗1molA,同时生成3molB
(3)若该反应放出热量,升高温度时,化学反应速率______(填“增大”或“减小”),平衡向______(填“正”或“逆”)反应方向移动。
(4)下图是电解NaCl溶液的示意图。请回答下列问题:
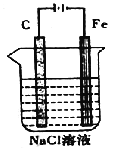
① 石墨电极上的反应式为_____________;
② 电解一段时间后,溶液的pH______(填“增大”“减小”或“不变”)。
(5)水溶液中的离子平衡是化学反应原理的重要内容。请回答下列问题:
① 常温下,0.1mol/LNH4Cl溶液呈______(填“酸”“碱”或“中”)性,溶液中c(NH4+)____c(Cl-)(填“>”“< ”或“=”);
② 已知:20℃时,Ksp(AgCl)=1.1×10-10, Ksp(AgBr)=2.0×10-13。在浓度均为0.01mol/L的NaCl和NaBr混合溶液中,逐滴加入AgNO3溶液,先产生的沉淀是_____(填“AgCl”或“AgBr ”)。
【答案】 3A(g)+B(g)![]() 2C(g) 1.5 B 增大 逆 2Cl--2e-=Cl2↑ 增大 酸 < AgBr
2C(g) 1.5 B 增大 逆 2Cl--2e-=Cl2↑ 增大 酸 < AgBr
【解析】(1)考查化学反应速率的计算,A和B物质的量浓度降低,说明作反应物,C物质的量浓度增大,说明生成物,在2min时达到平衡,说明是可逆反应反应,系数比等于物质的量浓度变化比,即为(6-3):(4-3):2=3:1:2,反应方程式为:3A(g)+B(g)![]() 2C(g);根据化学反应速率的数学表达式,v(A)=(6-3)/2mol/(L·min)=1.5 mol/(L·min);(2)考查判断达到化学平衡状态,A、化学平衡是动态平衡,v(正)=v(逆)≠0,故A错误;B、根据化学平衡状态的定义,各组分的浓度不再改变,说明反应达到平衡,故B正确;C、用不同种物质表示达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,消耗A,说明反应向正反应方向进行,生成B反应向逆反应方向进行,但消耗1molA,生成3molB,与化学计量数不成比例,不能说明反应达到平衡,故C错误;(3)考查影响化学反应速率的因素和化学平衡移动的因素,升高温度,化学反应速率增大;该反应是放热反应,升高温度,平衡向逆反应方向移动;(4)考查电解原理,①石墨连接电源的正极,因此电极反应式为2Cl-2e-=Cl2↑;②电解总反应是2NaCl+2H2O=2NaOH+H2↑+Cl2↑,溶液pH增大;(5)考查溶液酸碱性、离子浓度大小比较、溶度积,①NH4Cl属于强酸弱碱盐,溶液显酸性,因为NH4+发生水解,因此c(NH4+)<c(Cl-);②同等形式时,相同浓度条件下,溶度积越小,首先作为沉淀沉降出来,因此先产生沉淀的是AgBr。
2C(g);根据化学反应速率的数学表达式,v(A)=(6-3)/2mol/(L·min)=1.5 mol/(L·min);(2)考查判断达到化学平衡状态,A、化学平衡是动态平衡,v(正)=v(逆)≠0,故A错误;B、根据化学平衡状态的定义,各组分的浓度不再改变,说明反应达到平衡,故B正确;C、用不同种物质表示达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,消耗A,说明反应向正反应方向进行,生成B反应向逆反应方向进行,但消耗1molA,生成3molB,与化学计量数不成比例,不能说明反应达到平衡,故C错误;(3)考查影响化学反应速率的因素和化学平衡移动的因素,升高温度,化学反应速率增大;该反应是放热反应,升高温度,平衡向逆反应方向移动;(4)考查电解原理,①石墨连接电源的正极,因此电极反应式为2Cl-2e-=Cl2↑;②电解总反应是2NaCl+2H2O=2NaOH+H2↑+Cl2↑,溶液pH增大;(5)考查溶液酸碱性、离子浓度大小比较、溶度积,①NH4Cl属于强酸弱碱盐,溶液显酸性,因为NH4+发生水解,因此c(NH4+)<c(Cl-);②同等形式时,相同浓度条件下,溶度积越小,首先作为沉淀沉降出来,因此先产生沉淀的是AgBr。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案