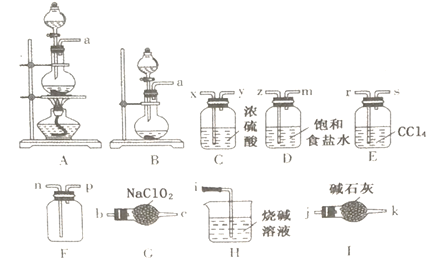
题目内容
【题目】已知:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=﹣1452kJmol﹣1
H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJmol﹣1
下列说法正确的是( )
A.H2(g)的燃烧热为571.6 kJ?mol﹣1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.![]() ?H2SO4(aq)+
?H2SO4(aq)+ ![]() ?Ba(OH)2(aq)=
?Ba(OH)2(aq)= ![]() ?BaSO4(s)+H2O(l)△H=﹣57.3 kJ?mol﹣1
?BaSO4(s)+H2O(l)△H=﹣57.3 kJ?mol﹣1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol﹣1
【答案】B
【解析】解:A.燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物所放出的热量,所以H2的燃烧热为 ![]() ×571.6 KJ/mol,故A错误;
×571.6 KJ/mol,故A错误;
B.令H2(g)和CH3OH(l)的质量都为1g,则1g氢气燃烧放热为 ![]() ×
× ![]() ×571.6=142.45KJ,1gCH3OH燃烧放热为
×571.6=142.45KJ,1gCH3OH燃烧放热为 ![]() ×
× ![]() ×1452=22.68KJ,所以H2(g)放出的热量多,故B正确;
×1452=22.68KJ,所以H2(g)放出的热量多,故B正确;
C.中和热是强酸强碱的稀溶液完全反应生成1mol水时放出的热量,故C错误;
D.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1改写为3H2(g)+ ![]() O2(g)═3H2O(l)△H=﹣(
O2(g)═3H2O(l)△H=﹣( ![]() ×571.6)kJmol﹣1 ,
×571.6)kJmol﹣1 ,
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1452kJmol﹣1改写为CO2(g)+2H2O(l)=CH3OH(l)+ ![]() O2(g))△H=+(
O2(g))△H=+( ![]() ×1452)kJmol﹣1 .
×1452)kJmol﹣1 .
改写后的方程相加即得3H2(g)+CO2(g)=CH3OH(l)+H2O(l),所以其△H═﹣( ![]() ×571.6)+(
×571.6)+( ![]() ×1452)=﹣131.4kJmol﹣1 . 故D错误.
×1452)=﹣131.4kJmol﹣1 . 故D错误.
故选B.

【题目】珍珠的主要成分是一种钙盐。将其加入稀盐酸中,有气泡产生,生成的气体无气味,而且能使澄清石灰水变浑浊,则珍珠的主要成分是
A. CaCO3 B. CaCl2 C. Ca(OH)2 D. CaSO4
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的(填仪器名称)的初始读数.
如果液面位置如右图所示,则此时的读数为mL.![]()
(4)滴定.当时,停止滴定,
并记录NaOH溶液的终读数.重复滴定3次.
(5)Ⅱ.实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
经计算,市售白醋总酸量=g/100mL.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时距离摇动,有少量液体溅出.