题目内容
【题目】如图为一种固体离子导体电池与湿润KI试纸AB连接,Ag+可以在RbAg4I5晶体中迁移,空气中的氧气透过聚四氯乙烯膜与AlI3反应生成I2,Ag与I2作用形成电池。下列说法中正确的是( )
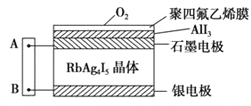
A. 试纸B端发生氧化反应 B. Ag+从石墨电极移向银电极
C. 试纸A端发生反应:2I--2e-=I2 D. 若该电池转移1mol电子,则滤纸上生成8gO2
【答案】C
【解析】解:Ag和I2作用形成原电池,生成物为RbAg4I5,可以知道在反应中Ag被氧化,为电池的负极反应, I2被还原,为原电池的正极反应,原电池工作时,阳离子向正极移动,阴离子向负极移动;A与正极相连为阳极,B与负极相连为阴极; 试纸B端为阴极,I2被还原, A错误;原电池中阳离子向正极移动,即Ag+从银电极移向石墨, B错误;试纸A端为阳极,为碘离子失电子发生氧化反应生成单质碘,C正确;电解碘化钾溶液,阳极碘离子先失电子变为碘单质,碘离子消耗完,才有氢氧根离子失电子变为氧气,因此该电池转移1mol电子,则滤纸上生成O2的量小于0.25mol,D错误;正确选项C。

练习册系列答案
相关题目
【题目】一定温度下,A、B、C三个容器中均进行同一个反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH =- Q kJ·mol-1,在相同的时间段内,测得如下数据:
2NH3(g) ΔH =- Q kJ·mol-1,在相同的时间段内,测得如下数据:
容器 | A | B | C |
反应速率/mol·L-1·min-1 | v(H2) = 3 | v(N2) = 3 | v(NH3) = 4 |
则三个容器放出的热量Q的大小关系为( )
A. B > C > A B. A > B > C C. C > A > B D. B > A > C