题目内容
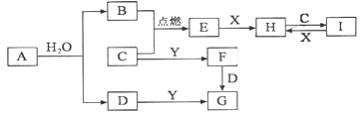
【题目】铝是应用广泛的金属,以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是___________________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。

其中,离子交换膜使用的是__________(阳离子交换膜、阴离子交换膜),阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
【答案】 Al2O3+2OH-=2AlO2-+H2O 减小 石墨电极被阳极上产生的O2氧化 阳离子交换膜 4CO32-+2H2O-4e-=4HCO3-+O2↑ H2 NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
【解析】本题主要考查对于“以铝土矿为原料制备铝的一种工艺流程”的评价。
(1)“碱溶”时生成偏铝酸钠的离子方程式为Al2O3+2OH-=2AlO2-+H2O。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,![]() +
+![]() +H2O
+H2O![]() Al(OH)3↓+
Al(OH)3↓+![]() ,水解程度:
,水解程度:![]() >
>![]() ,溶液的pH减小。
,溶液的pH减小。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是石墨电极被阳极上产生的O2氧化。
(4)需要限制阴离子OH-移动,所以离子交换膜使用的是阳离子交换膜,阳极的电极反应式为4CO32-+2H2O-4e-=4HCO3-+O2↑,阴极产生的物质A的化学式为H2。
(5)在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】硼酸(H3BO3)溶液中存在反应:H3BO3(aq)+H2O(l) ![]() [B(OH)4]-(aq)+H+(aq)。结合下表,下列说法正确的是( )
[B(OH)4]-(aq)+H+(aq)。结合下表,下列说法正确的是( )
化学式 | 硼酸 | 碳酸 | 醋酸 |
电离常数(298 K) | K=5.7×10-10 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
A. 将少量醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
B. 往碳酸钠溶液加入过量硼酸,没有明显变化,说明没有发生反应
C. 硼酸是三元弱酸,酸性比碳酸强
D. 等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者