题目内容
(6分)氨在国民经济中占有重要的地位,请参与下列探究
(1)已知在400℃时,2NH3(g) N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
①400℃时,N2 (g)+ 3H2(g) 2NH3(g)的K= (填数值)。
2NH3(g)的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(NH3)正 V(NH3)逆(填:>、<、=、不能确定)。
(2)已知: =H2O(l) △H=—285.8 kJ·
=H2O(l) △H=—285.8 kJ· …①
…①
 =NO2(g) △H=+33.9 kJ·
=NO2(g) △H=+33.9 kJ· …②
…②
 =NH3(g) △H=—46.0 kJ·
=NH3(g) △H=—46.0 kJ· …③
…③
H2O(l)=H2O(g) △H=+44 kJ· …④
…④
则表示NH3燃烧热的热化学方程式为
(1)已知在400℃时,2NH3(g)
 N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,①400℃时,N2 (g)+ 3H2(g)
 2NH3(g)的K= (填数值)。
2NH3(g)的K= (填数值)。②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(NH3)正 V(NH3)逆(填:>、<、=、不能确定)。
(2)已知:
 =H2O(l) △H=—285.8 kJ·
=H2O(l) △H=—285.8 kJ· …①
…① =NO2(g) △H=+33.9 kJ·
=NO2(g) △H=+33.9 kJ· …②
…②  =NH3(g) △H=—46.0 kJ·
=NH3(g) △H=—46.0 kJ· …③
…③H2O(l)=H2O(g) △H=+44 kJ·
 …④
…④则表示NH3燃烧热的热化学方程式为
(1)① 1/2 ;② =
(2)NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol
(2)NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol
(1)①根据平衡常数的表达式可知,逆反应的平衡常数是正反应的平衡常数的倒数,因此K=0.5。
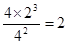 ②此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以 ,因此正逆反应速率相等。
②此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以 ,因此正逆反应速率相等。
(2)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据盖斯定律可知,①×3/2-③即得到NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l),所以反应热是—285.8 kJ· ×1.5+46.0 kJ·
×1.5+46.0 kJ· =-382.7 kJ/mol,所以热化学方程式为NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol。
=-382.7 kJ/mol,所以热化学方程式为NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol。
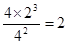 ②此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以 ,因此正逆反应速率相等。
②此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以 ,因此正逆反应速率相等。(2)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据盖斯定律可知,①×3/2-③即得到NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l),所以反应热是—285.8 kJ·
 ×1.5+46.0 kJ·
×1.5+46.0 kJ· =-382.7 kJ/mol,所以热化学方程式为NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol。
=-382.7 kJ/mol,所以热化学方程式为NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol。
练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目