题目内容
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:取出少量黑色固体,洗涤后,___(填操作和现象),证明黑色固体中含有Ag。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___(用离子方程式表示)。针对两种观点继续实验:

①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于___(用离子方程式表示),可氧化产生Fe3+;
假设c:酸性溶液中存在的___离子具有氧化性,可氧化产生Fe3+;
假设d:根据加入KSCN溶液后产生白色沉淀的现象,判断溶液中一定存在Ag+,Ag+可氧化Fe2+产生Fe3+。
③下述实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的___溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min时溶液呈浅红色,30min后溶液几乎无色。
实验Ⅱ:设计实验证明假设d成立___。
(3)根据ⅰ~ⅲ实验现象,结合本题涉及的三个方程式,推测实验ⅰ~ⅲ中Fe3+浓度变化的原因(用离子方程式和文字结合表述):___。
【答案】加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀 2Fe3++Fe=3Fe2+ 4Fe2++O2+4H+=4Fe3++2H2O NO3- 0.05mol·L-1NaNO3 分别取用不同浓度(均小于0.05mol·L-1)的硝酸银溶液与FeSO4溶液混合,取上层清液滴加KSCN溶液,观察是否变红及红色深浅,如果变红,且红色深浅与Ag+浓度大小有关,证明假设d成立 溶液中存在反应:①2Ag++Fe=Fe2++2Ag②Ag++Fe2+=Fe3++Ag③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大。约30min后,c(Ag+)小,以反应③为主,c(Fe3+)减小
【解析】
(1)Ag在加热条件下溶于稀硝酸,得到银离子,用氯离子检验可得;
(2)Fe过量,与铁离子价态归中得到亚铁离子;
②氧气在酸性条件下降亚铁离子氧化得到铁离子,根据电荷守恒和质量守恒书写可得;硝酸根离子在酸性条件下具有氧化性;
③证明假设abc错误,就是排除Ag+时实验比较,相当于没有Ag+存在的空白实验,考虑其他条件不要变化,可以选用NaNO3;证明d正确,则用不同浓度的硝酸银溶液与FeSO4溶液混合,与实验I类似对比不同浓度的硝酸银溶液对应的现象差异;
(3)i→ii Ag++Fe2+=Ag+Fe3+,反应生成Fe3+的使Fe3+浓度增加,ii→iii 溶液红色较3 0min时变浅,c(Ag+)小,反应为Fe+2Fe3+=3Fe2+,c(Fe3+)减小,溶液的颜色变浅。
(1)根据分析,取出少量黑色固体,洗涤后,加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀,证明黑色固体中含有Ag;
(2)乙认为铁粉过量时不可能有Fe3+,因为过量的Fe与铁离子发生反应生成亚铁离子,反应的离子方程式为:2Fe3++Fe=3Fe2+;
②假设b:空气中存在O2,氧气在酸性条件下将亚铁离子氧化为铁离子,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;
假设c:酸性溶液中存在的NO3,硝酸具有氧化性,可氧化产生Fe3+;
③证明假设abc错误,就是排除Ag+时实验比较,相当于没有Ag+存在的空白实验,考虑其他条件不要变化,可以选用NaNO3,故实验I为:向硝酸酸化的0.05 molL1 NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3 min时溶液呈浅红色,30 min后溶液几乎无色;
证明d正确,则用不同浓度的硝酸银溶液与FeSO4溶液混合,与实验I类似对比不同浓度的硝酸银溶液对应的现象差异,故实验II为:分别取用不同浓度(均小于0.05 molL1)的硝酸银溶液与FeSO4溶液混合,取上层清液滴加KSCN溶液,观察是否变红及红色深浅,如果变红,且红色深浅与Ag+浓度大小有关,证明假设d成立;
(3)溶液中存在反应:①2Ag++Fe=Fe2++2Ag②Ag++Fe2+=Fe3++Ag③Fe+2Fe3+=3Fe2+反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大,约30 min后,c(Ag+)小,以反应③为主,c(Fe3+)减小。

 53随堂测系列答案
53随堂测系列答案【题目】化学是一门以实验为基础的科学。
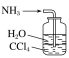
(1)用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是_____(填字母)。
A | B | C | D |
|
|
|
|
干燥氯气 | 吸收NH3 | 石油的分馏 | 制取乙酸乙酯 |
(2)为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐![]() 滤液
滤液![]() 精盐
精盐
①第Ⅰ步操作的名称是______。
②若第Ⅱ、Ⅳ步顺序颠倒,是否会对实验结果产生影响?_____(填“有影响”或“无影响”)。
③第Ⅴ步操作所需玻璃仪器的名称是________。