题目内容
【题目】下列各种溶液中通入或加入少量物质,使溶液导电能力增强的是 ( )
A. 盐酸中通入少量NH3 B. 醋酸中通入少量NH3
C. 氨水中加入少量H2O D. 盐酸中加入少量AgNO3
【答案】B
【解析】A. 氯化氢是强电解质,盐酸中通入少量NH3生成氯化铵,离子浓度基本不变,溶液导电能力基本不变,故A不选;B.醋酸是弱酸,醋酸中通入少量NH3生成醋酸铵,离子浓度增大,溶液导电能力增强,故B选;C. 氨水中加入少量H2O,溶液中的离子浓度减小,溶液导电能力减弱,故C不选;D. 盐酸中加入少量AgNO3反应生成氯化银沉淀和硝酸,离子浓度基本不变,溶液导电能力基本不变,故D不选;故选B。

【题目】利用可再生能源代替石油和煤已经成为未来发展的趋势。甲醇作为重要的可再生能源具有广泛的开发和应用前景。工业上常利用反应CO(g)+2H2(g)![]() CH3OH(g)△H<0来合成甲醇.
CH3OH(g)△H<0来合成甲醇.
(1)经研究发现在230℃~270℃时合成最为有利.为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如下图。230℃的实验结果所对应的曲线是______(填字母);从提高CO转化率的角度等综合分析,该温度下工业生产适宜采用的合成气组成n(H2):n(CO)的比值范围是______(填字母).

A.1~1.5B.2.5~3C.3.5~4.5
(2)制甲醇所需要的氢气,可通过下列反应制取:H2O(g)+CO(g)![]() H2(g)+CO2(g)△H<0,某温度下该反应的平衡常数K=1.回答下列问题:
H2(g)+CO2(g)△H<0,某温度下该反应的平衡常数K=1.回答下列问题:
①该温度下,若起始时c(CO)=2mol/L,c(H2O)=3mol/L,反应进行一段时间后,测得CO的浓度为1mol/L,则此时该反应v(正)______v(逆)(填“>”、“<”或“=”).
②若降低温度,该反应的K值将______(填“增大”、“减小”或“不变”).
(3)甲醇是一种化工原料,工业上合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g)△H=-90.8kJ/mol.
CH3OH(g)△H=-90.8kJ/mol.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCO、4molH2 |
CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
①容器内压强P:P甲、P乙与P丙的关系是______(用“>”、“<”或“=”表示);
②变化的热量数值Q中,Q1与Q2的和是______(填具体数值).
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是 __________(填写
化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶
液中,反应的离子方程式为__________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:取稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用硫酸将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4h后红纸褪色 |
已知,溶液中Cl2、HC1O和ClO-物质的量分数(α) 随pH变化的关系如右图所示:
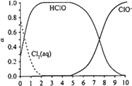
①由实验现象可获得以下结论:溶液的pH在4 ~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应,生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是将SO2通入硫酸酸化的NaC1O3溶液中,反应的离子方程式为__________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3。则每生成0.5 mol ClO2,转移__________mole-。