题目内容
下表是元素周期表的一部分,针对所给的9种元素,完成下列各小题.
(1)非金属性最强的元素是:______;
(2)H2O的电子式:______;
(3)Ar原子结构示意图为:______;
(4)NaOH与Al(OH)3中,碱性较强的是:______;
(5)制作光导纤维的主要材料是:______;
(6)N与C中,原子半径较小的是:______;
(7)Al2O3与盐酸反应的化学方程式:______.
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | Cl | Ar |
(2)H2O的电子式:______;
(3)Ar原子结构示意图为:______;
(4)NaOH与Al(OH)3中,碱性较强的是:______;
(5)制作光导纤维的主要材料是:______;
(6)N与C中,原子半径较小的是:______;
(7)Al2O3与盐酸反应的化学方程式:______.
(1)稀有气体的化学性质最不活泼,Ar为稀有气体,故答案为:Ar;
(2)水为共价化合物,H和O通过共用电子对结合,电子式为: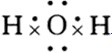 ,故答案为:
,故答案为: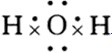 ;
;
(3)Ar原子质子数为18,核外电子数为18,K层2、L层8、M层8,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)金属性越强,其最高价氧化物的水化物的碱性越强,金属性:Na>Al,因此碱性:NaOH>Al(OH)3,故答案为:NaOH;
(5)制造光导纤维的主要原料是二氧化硅,故答案为:SiO2;
(6)同周期自左到右原子半径逐渐减小,因此原子半径:C>N,故答案为:N;
(7)Al2O3 与盐酸反应生成氯化铝和水,化学方程式为:Al2O3+6HCl=2AlCl3+3H2O,故答案为:Al2O3+6HCl=2AlCl3+3H2O.
(2)水为共价化合物,H和O通过共用电子对结合,电子式为:
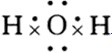 ,故答案为:
,故答案为: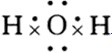 ;
;(3)Ar原子质子数为18,核外电子数为18,K层2、L层8、M层8,原子结构示意图为
 ,故答案为:
,故答案为: ;
;(4)金属性越强,其最高价氧化物的水化物的碱性越强,金属性:Na>Al,因此碱性:NaOH>Al(OH)3,故答案为:NaOH;
(5)制造光导纤维的主要原料是二氧化硅,故答案为:SiO2;
(6)同周期自左到右原子半径逐渐减小,因此原子半径:C>N,故答案为:N;
(7)Al2O3 与盐酸反应生成氯化铝和水,化学方程式为:Al2O3+6HCl=2AlCl3+3H2O,故答案为:Al2O3+6HCl=2AlCl3+3H2O.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


