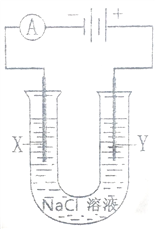
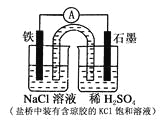
��Ŀ����
����Ŀ��������ؼ������
��19.6�������� mol H2SO4 �� ���� ��ԭ�ӣ�1.7��NH3��ͬ��ͬѹ���� ��H2S���庬�е���ԭ������ͬ��
���ڱ�״���£�1.6gij��̬������RO2���Ϊ0.56L������������ʵ����� Ħ�������� ��R�����ԭ����Ϊ
����֪Wg����A����a�����ӣ���ô�ڱ�״���£�bg����A��ռ������� �����а����ӵ�������NA��ʾ��
�ܱ�״���£��ܶ�Ϊ0.75g/L��NH3��CH4��ɵĻ�������У�NH3��������� ����������ƽ��Ħ������Ϊ �����������������ܶ�Ϊ ��
���𰸡�0.2��1.4NA��5.1��0.025mol��64g/mol��32��![]()
![]() ��80%��16.8g/mol��8.4
��80%��16.8g/mol��8.4
���������⣺��19.6g��������ʵ���n= ![]() =
= ![]() =0.2mol��������Ϊ7ԭ�ӷ��ӣ���0.2mol�����к���1.4molԭ�ӣ�����Ϊ1.4NA����1.7g���������ʵ���Ϊn=
=0.2mol��������Ϊ7ԭ�ӷ��ӣ���0.2mol�����к���1.4molԭ�ӣ�����Ϊ1.4NA����1.7g���������ʵ���Ϊn= ![]() =0.1mol���������к�3��Hԭ�ӣ���0.1mol�����к�0.3molHԭ�ӣ���H2S�к�2��Hԭ�ӣ��ʺ���ͬHԭ������H2S�����ʵ���Ϊn=
=0.1mol���������к�3��Hԭ�ӣ���0.1mol�����к�0.3molHԭ�ӣ���H2S�к�2��Hԭ�ӣ��ʺ���ͬHԭ������H2S�����ʵ���Ϊn= ![]() =0.15mol������m=nM=0.15mol��34g/mol=5.1g�����Դ��ǣ�0.2��1.4NA��5.1���ڱ�״���£�Vm=222.4L/mol��1.6gij��̬������RO2�����Ϊ0.56L�������ʵ���Ϊ
=0.15mol������m=nM=0.15mol��34g/mol=5.1g�����Դ��ǣ�0.2��1.4NA��5.1���ڱ�״���£�Vm=222.4L/mol��1.6gij��̬������RO2�����Ϊ0.56L�������ʵ���Ϊ ![]() =0.025mol����Ħ������Ϊ
=0.025mol����Ħ������Ϊ ![]() =64g/mol����RO2����Է�������Ϊ64����R�����ԭ������=64��16��2=32�����Դ��ǣ�0.025mol��64g/mol��32����Wg����A����a�����ӣ���bg���庬�еķ�����Ϊx�������У�
=64g/mol����RO2����Է�������Ϊ64����R�����ԭ������=64��16��2=32�����Դ��ǣ�0.025mol��64g/mol��32����Wg����A����a�����ӣ���bg���庬�еķ�����Ϊx�������У� ![]() �����x=
�����x= ![]() ���ڱ���µ����V=
���ڱ���µ����V= ![]() =
= ![]() =
= ![]() L�����Դ��ǣ�
L�����Դ��ǣ� ![]() L���ܻ�������ڱ�״���µ��ܶ�Ϊ0.75g/L�����������ƽ��Ħ������Ϊ0.75g/L��22.4L/mol=16.8g/mol������ʮ�ֽ��淨������������NH3��CH4������ȣ�
L���ܻ�������ڱ�״���µ��ܶ�Ϊ0.75g/L�����������ƽ��Ħ������Ϊ0.75g/L��22.4L/mol=16.8g/mol������ʮ�ֽ��淨������������NH3��CH4������ȣ� 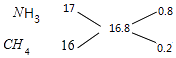 ���Ի��������NH3��CH4�������Ϊ0.8��0.2=4��1�����������������=
���Ի��������NH3��CH4�������Ϊ0.8��0.2=4��1�����������������= ![]() =80%�����ڻ�������ƽ��Ħ������Ϊ16.8g/mol����������Ħ������Ϊ2g/mol���ʻ�����������������ܶ�Ϊ
=80%�����ڻ�������ƽ��Ħ������Ϊ16.8g/mol����������Ħ������Ϊ2g/mol���ʻ�����������������ܶ�Ϊ ![]() =8.4�����Դ��ǣ�80%��16.8g/mol��8.4��
=8.4�����Դ��ǣ�80%��16.8g/mol��8.4��

 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�