题目内容
写出下列物质的电子式:(1)Ca(OH)2 ,H2O
(2)NH3 ,MgO ,
(3)Na2O2 ,CCl4 .
【答案】分析:首先判断化合物是离子化合物还是共价化合物;
若是离子化合物,其电子式 由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况.
解答:解:(1)Ca(OH)2是离子化合物,由由Ca2+离子和OH-离子构成,Ca(OH)2的电子式为 ,
,
H2O是共价化合物,氧原子分别与两个氢原子通过一对共用电子对结合,H2O电子式为 ,
,
故答案为: ;
; ;
;
(2)NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为 ,
,
MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式为 ;
;
故答案为: ;
; ;
;
(3)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,
,
CCl4是共价化合物,碳原子分别与4个氯原子通过一对共用电子对结合,CCl4电子式为 ,
,
故答案为: ;
; .
.
点评:本题考查化学键的类型以及电子式的书写,题目难度不大,注意离子键与共价键的区别以及电子式的书写方法,原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况.
若是离子化合物,其电子式 由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况.
解答:解:(1)Ca(OH)2是离子化合物,由由Ca2+离子和OH-离子构成,Ca(OH)2的电子式为
 ,
,H2O是共价化合物,氧原子分别与两个氢原子通过一对共用电子对结合,H2O电子式为
 ,
,故答案为:
 ;
; ;
;(2)NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为
 ,
,MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式为
 ;
;故答案为:
 ;
; ;
;(3)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为
 ,
,CCl4是共价化合物,碳原子分别与4个氯原子通过一对共用电子对结合,CCl4电子式为
 ,
,故答案为:
 ;
; .
.点评:本题考查化学键的类型以及电子式的书写,题目难度不大,注意离子键与共价键的区别以及电子式的书写方法,原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目





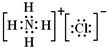















 I2+Z+H2O,其中的R元素.
I2+Z+H2O,其中的R元素.