题目内容
Ⅰ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2→O2.
(1)该反应中的还原剂是______.
(2)该反应中,发生还原反应的过程是______→______.
(3)该反应中氧化剂与还原剂物质的量之比为______.
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为______.
Ⅱ.已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
请运用盖斯定律写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:______.
解:Ⅰ、(1)由信息H2O2-→O2中可知,O元素的化合价由-1价升高到0,则H2O2为还原剂,故答案为:H2O2;
(2)氧化剂发生还原反应,含元素化合价降低的物质为氧化剂,则Cr元素的化合价降低,即还原反应的过程为
H2CrO4→Cr(OH)3,故答案为:H2CrO4;Cr(OH)3;
(3)该反应中O元素失电子,Cr元素得到电子,2molH2CrO4反应转移电子为2mol×(6-3)=6mol,所以氧元素得到电子为6mol,则反应的方程式为:2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,氧化剂H2CrO4和还原剂H2O2的物质的量之比是2:3,故答案为:2:3;
(4)由2H2CrO4+3H2O2═2Cr(OH)3+3O2↑+2H2O可知,生成3mol气体转移6mol电子,则转移了0.3mol电子,则产生的气体的物质的量为 ×3mol=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L;
×3mol=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L;
Ⅱ、解:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
分析:(1)由H2O2只发生如下过程H2O2→O2可知,利用该过程中O元素的化合价由-1价升高到0来分析;
(2)氧化剂发生还原反应,利用元素的化合价降低来分析;
(3)根据电子守恒来书写化学方程式,确定氧化剂和还原剂的物质的量之比;
(4)由反应可知生成3mol气体转移6mol电子,以此来计算.
(5)根据盖斯定律将三个化学方程式进行处理来求焓变.
点评:本题考查学生氧化还原反应和反应热的计算等知识,题目难度较大,注意电子守恒以及盖斯定律的灵活应用.
(2)氧化剂发生还原反应,含元素化合价降低的物质为氧化剂,则Cr元素的化合价降低,即还原反应的过程为
H2CrO4→Cr(OH)3,故答案为:H2CrO4;Cr(OH)3;
(3)该反应中O元素失电子,Cr元素得到电子,2molH2CrO4反应转移电子为2mol×(6-3)=6mol,所以氧元素得到电子为6mol,则反应的方程式为:2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,氧化剂H2CrO4和还原剂H2O2的物质的量之比是2:3,故答案为:2:3;
(4)由2H2CrO4+3H2O2═2Cr(OH)3+3O2↑+2H2O可知,生成3mol气体转移6mol电子,则转移了0.3mol电子,则产生的气体的物质的量为
 ×3mol=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L;
×3mol=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L;Ⅱ、解:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
分析:(1)由H2O2只发生如下过程H2O2→O2可知,利用该过程中O元素的化合价由-1价升高到0来分析;
(2)氧化剂发生还原反应,利用元素的化合价降低来分析;
(3)根据电子守恒来书写化学方程式,确定氧化剂和还原剂的物质的量之比;
(4)由反应可知生成3mol气体转移6mol电子,以此来计算.
(5)根据盖斯定律将三个化学方程式进行处理来求焓变.
点评:本题考查学生氧化还原反应和反应热的计算等知识,题目难度较大,注意电子守恒以及盖斯定律的灵活应用.

练习册系列答案
相关题目
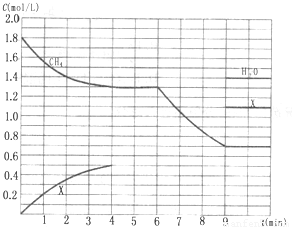
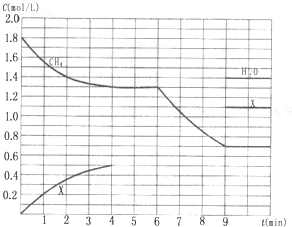 向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有: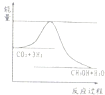
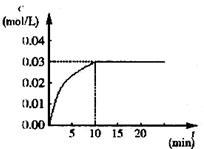 0.3 mol的CO和0.3 mol的H2O,在催化剂存
0.3 mol的CO和0.3 mol的H2O,在催化剂存