题目内容
6.(1)Cu(NO3)2的水溶液呈酸(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):Cu2++2H2O?Cu(OH)2+2H+;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制(填“促进”、“抑制”)其水解.(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3.
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的NaOH.
(4)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOHpH由大到小的顺序为:⑥>②>③>①>⑤>④.
分析 (1)Cu(NO3)2中的铜离子在水中易水解,而显酸性;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,为了抑制其水解.
(2)氯化铝水溶液加热促进水解,生成的HCl挥发,最后蒸干,灼烧得到Al2O3;
(3)硫化钠在溶液中水解生成NaOH;
(4)先根据酸碱盐分类,再根据酸中酸的强弱分类,盐中盐的水解呈酸碱性分类比较.
解答 解:(1)Cu(NO3)2中的铜离子在水中易水解,而显酸性,水解方程为:Cu2++2H2O?Cu(OH)2+2H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,为了抑制其水解,故答案为:酸;Cu2++2H2O?Cu(OH)2+2H+;抑制;
(2)氯化铝水溶液中铝离子水解显酸性,其水解方程式为:Al3++3H2O?Al(OH)3+3H+,其溶液加热促进水解,生成的HCl挥发,最后蒸干,灼烧得到Al2O3,
故答案为:Al2O3;
(3)硫化钠在溶液中水解生成NaOH,所以为了防止发生水解,可以加入少量的NaOH,故答案为:NaOH;
(4)酸:CH3COOH 是弱电解质,所以只有部分电离,故C(H +)<0.1mol/L,所以PH>1;
碱:⑥NaOH是强电解质,完全电离,C(OH- )=0.1mol/L,所以PH=13;
盐:④NaHSO4是强酸酸式盐,在水中完全电离成钠离子、硫酸根离子、氢离子,所以C(H +)=0.1mol/L,所以PH=1;
①KNO3是强酸强碱盐,水溶液呈中性,PH=7;
②Na2CO3 和③NaHCO3都是强碱弱酸盐,水溶液都呈碱性,但碳酸钠的水解程度大于碳酸氢钠 的水解程度,所以碳酸钠溶液的碱性大于碳酸氢钠溶液的碱性.
故答案为:⑥>②>③>①>⑤>④.
点评 本题考查了盐类水解的有关知识,注意影响水解平衡的因素,题目比较基础,注意盐类水解规律:有弱(弱离子)才水解,无弱(弱离子)不水解,谁弱(弱离子)谁水解,谁强显谁性(酸碱性).

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| A. | 漂白粉 | B. | 过氧化钠 | C. | 氯水 | D. | 硫酸钠 |
| A. | NaCl固体溶于水 | B. | Br2与H2生成HBr | C. | SO2气体溶于水 | D. | 干冰升华 |
| A. | Na2C03是发酵粉的主要成分之一 | B. | Mg0常用作耐高温材料 | ||
| C. | SiO2可用于制造光导纤维 | D. | 工业上可用Cl2制造漂白粉 |
| A. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| B. | 大量燃烧化石燃料是造成雾霾天气的重要因素之一 | |
| C. | 粗铜提纯电解时精铜作阳极,选择CuSO4溶液作电解液 | |
| D. | 目前以水为原料获得廉价、丰富的氢能的技术仍有待突破 |
| A. | 通过化学变化一定能改变物质的性质 | |
| B. | 人们所使用的材料,都是纯度越高越好 | |
| C. | 氧化还原反应中一定会发生电子转移 | |
| D. | 某元素由化合态变为游离态,该元素有可能被氧化,也有可能被还原 |
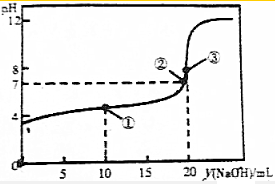 常温下,在20mL0.1mol•L-1 H2R溶液中滴加0.1mol•L-1 NaOH溶液,混合溶液的pH与滴加氢氧化钠溶液体积(V)的关系如图所示.下列说法不正确的是( )
常温下,在20mL0.1mol•L-1 H2R溶液中滴加0.1mol•L-1 NaOH溶液,混合溶液的pH与滴加氢氧化钠溶液体积(V)的关系如图所示.下列说法不正确的是( )| A. | HR-的电离程度大于水解程度 | |
| B. | ②点对应溶液中离子浓度的关系c(Na+)<c(H2R)+c(HR-)+c(R2-) | |
| C. | 在①、②、③点对应的溶液中,水电离的c(H+)•c(OH-)最大的是③ | |
| D. | 滴定前,溶液中存在粒子浓度大小关系:c(H2R)>c(H+)>c(HR-)>c(R2-)>c(OH-) |
