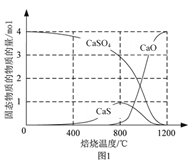
题目内容
【题目】对某一可逆反应来说,使用催化剂的作用是
A.催化剂在反应前后质量不变,故催化剂不参与化学反应
B.降低反应活化能,使反应速率加快
C.催化剂能够改变反应的反应热
D.催化剂只改变反应的正反应速率
【答案】B
【解析】A项,催化剂是通过参与反应来改变化学反应速率的;B项,使用催化剂能降低反应活化能,使部分能量较低的分子转化为活化分子,增加了单位体积内活化分子百分数,使反应速率加快;C项,反应的反应热与反应物和生成物的能量有关,与反应的过程无关,故催化剂不能改变反应的反应热;D项,对某一可逆反应来说,使用催化剂,可以同等程度地改变正、逆反应的速率。本题选B。

【题目】湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。一种由铜镉渣生产金属镉的流程如下:
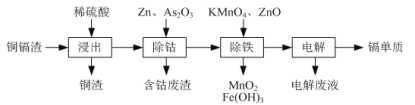
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol/L计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是__________________。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3。该微电池的正极反应式为_____。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
① 除铁过程中,理论上参加反应的物质n(KMnO4)∶n(Fe2+)=_________。
② 除铁时加入ZnO控制反应液pH的范围为________________。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:_____________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_____。