题目内容
【题目】Ⅰ.已知:H2A的A2-可表示S2-、SO42-、SO32-、SiO32-或CO32-。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
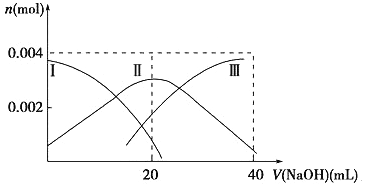
当V(NaOH)=20 mL时,溶液中离子浓度大小关系:____________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水____________(填“大”、“小”或“相等”)。
(2)若H2A为硫酸:t℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=____________。
Ⅱ.已知:在25 ℃时 H2O![]() H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH![]() H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh具体数值=________________,
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a,1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为___________, a与b的关系为______________。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数为____________。
【答案】(1)①c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) ②小
(2)10-13 (3)Kh=5.6×10-10
(4)小于、大于(5) b·10-7/(a-b)
【解析】
试题分析:Ⅰ.(1)①当V(NaOH)=20 mL时,二者恰好反应生成NaHA,根据图像可知A2-浓度大于H2A浓度,这说明HA-的电离程度大于水解程度,溶液显酸性,则溶液中离子浓度大小关系为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
②等体积等浓度的NaOH溶液与H2A溶液混合后生成NaHA,HA-的电离程度大于水解程度,溶液显酸性,所以其溶液中水的电离程度比纯水小。
(2)若H2A为硫酸:t℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则氢氧化钠溶液中氢氧根的浓度是0.01mol/L,所以该温度下水的离子积常数KW=10-11×0.01=10-13。
Ⅱ(3)醋酸钠水解的平衡常数Kh=![]() =5.6×10-10;
=5.6×10-10;
(4)稀释促进水解,即醋酸根浓度越小水解程度越大,则a>b;醋酸钠的浓度越小,碱性越弱,pH越小,则m<n;
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则根据电荷守恒可知溶液中c(NH4+)=c(Cl-)=0.5bmol/L,溶液中一水合氨的浓度为0.5(a-b)mol/L,则用a、b表示NH3·H2O的电离平衡常数为![]() =b·10-7/(a-b)。
=b·10-7/(a-b)。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案

