题目内容
1.现有反应:A.CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO
D.2KOH+H2SO4=K2SO4+2H2O

(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图1的是C(填反应序号).
(2)在常温下,上述四个反应中可用于设计原电池的是B(填反应序号),根据该原电池回答下列问题:
①负极材料是Zn,负极发生氧化(填“氧化”或“还原”)反应;正极反应式为2H++2e-=H2↑.
②当导线中有1mol电子通过时,理论上发生的变化是bc(填序号).(相对原子质量:H1,Zn65)
a.溶液增重32.5g b.溶液增重31.5g
c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图2所示.
①m曲线表示锌与稀硫酸X(填“X”或“Y”)反应.
②锌分别与稀硫酸X、Y反应时,反应速率不同的原因是c(填序号).
a.CuSO4作催化剂
b.加入硫酸铜溶液增大了c(SO42-)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积.
分析 (1)图1中反应物的总能量低于生成物的总能量,此图表示的反应为吸热反应;
(2)常温下进行的反应是B和D,自发的氧化还原反应能用于设计成原电池,据此解答即可;
(3)铜锌与稀硫酸构成原电池,可以加快氢气的生成速率,据此解答即可.
解答 解:(1)图1中反应物的总能量低于生成物的总能量,此图表示的反应为吸热反应,
A、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,没有化合价的变化,不是氧化还原反应,故A错误;
B、Zn+H2SO4═ZnSO4+H2↑,金属与酸的反应为放热反应,故B错误;
C、C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO,此反应中C的化合价升高,二氧化碳中C元素化合价降低,属于氧化还原反应且为吸热反应,故C正确;
D、2KOH+H2SO4═K2SO4+2H2O,此反应为复分解反应,不属于氧化还原反应,故D错误;
故选C;
(2)B和C均为氧化还原反应,但是C不能在常温下进行,新与稀硫酸的反应为自发的氧化还原反应,能被设计成原电池,故答案为:B;
①Zn易失电子作负极,电极反应式为Zn-2e-=Zn2+,发生氧化反应,Cu或石墨作正极,正极上电极反应式为2H++2e-=H2↑,故答案为:Zn;氧化;2H++2e-=H2↑;
②导线中有1mol电子通过时,负极锌物质的量减小0.5mol,质量减小0.5mol×65g/mol=32.5g;铜片(或石墨)上放出氢气,阳极电子守恒生成氢气的物质的量0.5mol,质量为0.5mol×2g/mol=1g,故溶液增重32.5-1=31.5g,因为未说明气体所处的稳定与压强,故d错误,所以选项中bc正确,故选bc;
(3)①由图2可知,反应m反应速率比反应n快,m曲线表示锌与稀硫酸中加入少量饱和CuSO4溶液的反应,故答案为:X;
②由于锌是足量的,稀硫酸的物质的量相同,则产生氢气的质量相同,由于X中加入少量硫酸铜溶液,锌置换出少量的Cu,与Zn和稀硫酸构成原电池,加快反应速率,故答案为c.
点评 本题主要考查的是吸热反应与放热反应的判断.原电池工作原理以及化学反应速率的影响因素,综合性较强,有一定的难度.

 53随堂测系列答案
53随堂测系列答案| A. | 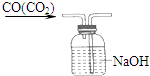 气体除杂 | B. | 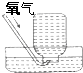 收集氧气 | C. | 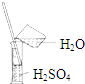 稀释溶液 | D. | 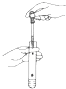 滴加溶液 |
| A. | 不变 | B. | 不能确定 | C. | 减少 | D. | 增大 |
| A. | 探究温度对反应速率影响时,应先分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度后再混合,不是先将两种溶液混合后再用水浴加热 | |
| B. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| C. | 使用含有氯化钠的融雪剂会加快铁桥梁的腐蚀 | |
| D. | 判断皂化反应是否完全,可取反应后的混合液滴入热水中 |
| A. | 在碱性溶液中:CO32-、K+、S2-、Na+ | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- | |
| C. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液中:NH4+、AlO2-、C1-、K+ | |
| D. | 在中性溶液中:Fe3+、C1-、NO3-、A13+ |
| A. | 少量稀HNO3中加入足量铁粉:Fe+4H++NO3-═NO↑+Fe3++2H2O | |
| B. | 以石墨作电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | NH4HCO3溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
| A. | 与12C60的碳原子化学性质不同 | B. | 与15N含的中子数相同 | ||
| C. | 与12C60互为同素异形体 | D. | 与12C、13C互为同系物 |
| A. | 灼热的炭与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 钢铁制品生锈的反应 |
 将全部由短周期元素组成的化合物X加热分解,可得A、B、C、D、E和H2O六种产物,其中A、B、C都是中学化学中常见的氧化物,气体D是单质E所含元素的氢化物.
将全部由短周期元素组成的化合物X加热分解,可得A、B、C、D、E和H2O六种产物,其中A、B、C都是中学化学中常见的氧化物,气体D是单质E所含元素的氢化物.