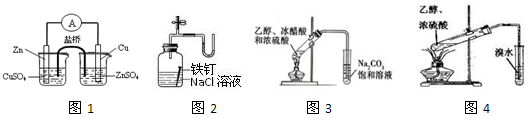
题目内容
(17分)下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500ml的操作,实验操作如下, 请把正确操作步骤(用1,2,3……表示)的序号填入括号内,并填写有关的空格:
( )将配好的稀硫酸倒入试剂瓶中,贴好标签;
( )盖好容量瓶塞,反复颠倒摇匀;
( )用量筒量取 ml的98% 的浓硫酸;
( )将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
( )用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
( )将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
( )改用_____________ 逐滴加蒸馏水,使溶液的______________ 正好跟刻度相平。
( )继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;请回答:
若在操作中没有把少量蒸馏水洗涤烧杯的洗涤液全部转移到容量瓶中,会使稀硫酸溶液的浓度 (填“大于”、“小于”或“等于”) 0.5mol/L,配制成稀H2SO4时若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线,会使稀硫酸溶液的浓度 (填“大于”、“小于”或“等于”) 0.5mol/L.
( )将配好的稀硫酸倒入试剂瓶中,贴好标签;
( )盖好容量瓶塞,反复颠倒摇匀;
( )用量筒量取 ml的98% 的浓硫酸;
( )将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
( )用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
( )将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
( )改用_____________ 逐滴加蒸馏水,使溶液的______________ 正好跟刻度相平。
( )继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;请回答:
若在操作中没有把少量蒸馏水洗涤烧杯的洗涤液全部转移到容量瓶中,会使稀硫酸溶液的浓度 (填“大于”、“小于”或“等于”) 0.5mol/L,配制成稀H2SO4时若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线,会使稀硫酸溶液的浓度 (填“大于”、“小于”或“等于”) 0.5mol/L.
(8)、(7)、(1)、 13.6 、(2)、浓硫酸、 水、(4)、(3)、容量瓶、(6)、胶头滴管、 凹液面、(5)、小于、小于。
考查一定物质的量浓度溶液的配制。硫酸的物质的量是0.5mol/L×0.5L=0.25mol,所以需要浓硫酸的体积是 。浓硫酸的稀释必需是将浓硫酸沿着器壁注入水中,并不断搅拌。根据c=n/V可知,如果没有洗涤,则溶质减少,浓度偏小;倒出的溶液中含有溶质,所以浓度偏小。
。浓硫酸的稀释必需是将浓硫酸沿着器壁注入水中,并不断搅拌。根据c=n/V可知,如果没有洗涤,则溶质减少,浓度偏小;倒出的溶液中含有溶质,所以浓度偏小。
 。浓硫酸的稀释必需是将浓硫酸沿着器壁注入水中,并不断搅拌。根据c=n/V可知,如果没有洗涤,则溶质减少,浓度偏小;倒出的溶液中含有溶质,所以浓度偏小。
。浓硫酸的稀释必需是将浓硫酸沿着器壁注入水中,并不断搅拌。根据c=n/V可知,如果没有洗涤,则溶质减少,浓度偏小;倒出的溶液中含有溶质,所以浓度偏小。
练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目