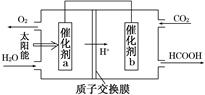
题目内容
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
① 工业合成氨的热化学方程式是 。
② 若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则
Q(填“>”、“<”或“=”)_______184.4 kJ。
③ 已知:
1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH(填“>”、“<”或“=”) 0
②在一定温度和压强下,若原料气中的NH3和CO2的物质 的量之比(氨碳比)
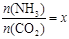 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。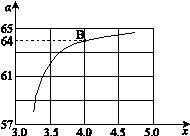
③ 上图中的B点处,NH3的平衡转化率为_______。
(3)氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
下面是利用氮气制备含氮化合物的一种途径:

①过程Ⅱ的化学方程式是
②运输时,严禁NH3与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,并且0.4 mol NH3参加反应时有0.3 mol 电子转移。写出反应的化学方程式
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH =" ―1316" kJ/mol,则该燃料电池的负极反应式是 。
(1)① N2(g)+3H2(g) =2NH3(g) ΔH=" –92.2" kJ/mol(2分)
② < (1分)
③391(2分)
(2)① < (2分)
②nNH3增大,平衡正向移动,则增大CO2的转化率 (2分)
③32%(2分)
(3)① N2 + 3H2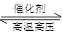 2NH3 (N2 + O2
2NH3 (N2 + O2 2NO)(2分)
2NO)(2分)
② 8NH3 + 3Cl2 = 6NH4Cl + N2 (2分)
③ 2NH3―6e- + 6OH- = N2↑+ 6H2O(2分)
解析试题分析:(1)①每产生2 mol NH3,放出92.2 kJ热量,所以工业合成氨的热化学方程式是N2(g)+3H2(g) =2NH3(g) ΔH=" –92.2" kJ/mol
②该反应为可逆反应,所以向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量小于92.2×2=184.4kJ
③ΔH=反应物的总键能-生成物的总键能,1mol氨气分子中有3molN-H键,设断开1molN-H键吸收的能量为x,则–92.2 kJ/mol="945.8kJ/mol+3×436" kJ/mol-2×3×x,解得x =391kJ/mol
(2)①温度升高,K值下降,说明随温度升高平衡逆向移动,逆向为吸热方向,四正反应为放热反应,ΔH<0②x逐渐增大,说明nNH3增大,平衡正向移动,则CO2的转化率α增大
③B点x=4,CO2平衡转化率为64%,若x=2,则NH3、CO2平衡转化率都为64%,现在NH3的起始物质的量扩大为原来的2倍,所以转化率降为原来的一半,为32%
(3)①氮的固定是把游离态氮转化为化合态氮的过程,包括合成氨:N2 + 3H2 2NH3 ,氮气与氧气的反应:N2 + O2
2NH3 ,氮气与氧气的反应:N2 + O2 2NO
2NO
②二者接触时剧烈反应产生白烟,说明有氯化铵生成,0.4 mol NH3参加反应时有0.3 mol 电子转移,说明氨气未被全部氧化为氮气,根据反应物、产物写出对应的化学方程式为8NH3 + 3Cl2 = 6NH4Cl + N2
③燃料电池的负极发生氧化反应,分析已知的方程式得氨气被氧化,所以负极发生的反应为2NH3―6e- + 6OH- = N2↑+ 6H2O
考点:考查合成氨工业中所涉及的热化学方程式的书写、反应热的计算、化学平衡知识、氮的固定、原电池的电极反应方程式的书写

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案甲醇是一种用途广泛的化工原料。
(1)工业上常用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) ΔH1= -90.1KJ/mol
②CO2(g)+ 3H2(g)  CH3OH(g) + H2O(l) ΔH2
CH3OH(g) + H2O(l) ΔH2
已知:CO(g)+ H2O (g) = CO2 (g) + H2 (g) ΔH3=-41.1 KJ/mol ③
H2O (l) =H2O (g) ΔH4=+44.0KJ/mol ④
则ΔH2=
(2)实验室模拟用CO和H2反应来制甲醇。在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol?L-1)变化如下表所示:(前6min没有改变条件)
| | 2min | 4min | 6min | 8min | … |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
①x= 。
②250℃时该反应的平衡常数K值为: (不必化简)。
③若6min~8min只改变了某一条件,所改变的条件是 。
④第8min时,该反应是不是达到平衡状态 。(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ. 。
(3)电解甲醇水溶液制氢的优点是需要的电压低,而且制得的氢气比电解相同物质的量的水多。写出电解甲醇水溶液的反应式为:阳极: 。
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)  H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)  H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g)  H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)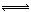 N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。
H<0。
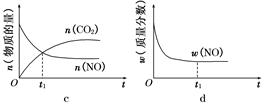
一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。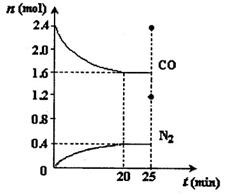
①NO的平衡转化率为 ,0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
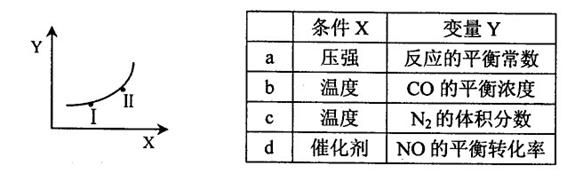
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。
|
 (3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02
 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化d.为保持放电效果,电池使用一段时间需更换电解质溶液
(1)①根据下列图示,写出反应的热化学方程式____________________________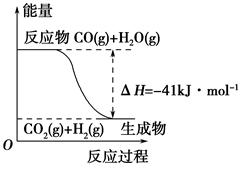
②根据如图所示情况,判断下列说法中正确的是______________。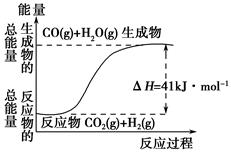
| A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1 |
| B.该反应为吸热反应 |
| C.该反应为放热反应 |
| D.当H2O为液态时,其反应热值小于41 kJ·mol-1 |
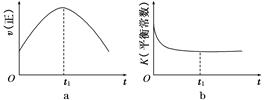
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为___________________________
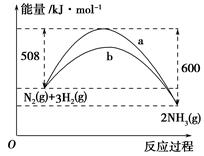
a、b两条曲线产生区别的原因很可能是
_________________________________________________________________。
 H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。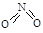 、
、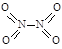 , NO2中氮氧键的键能为466 kJ·mol-1,N2O4中N-N键键能为167 kJ·mol-1,氮氧键的键能为438.5 kJ·mol-1,写出N2O4转化为NO2的热化学方程式 ;
, NO2中氮氧键的键能为466 kJ·mol-1,N2O4中N-N键键能为167 kJ·mol-1,氮氧键的键能为438.5 kJ·mol-1,写出N2O4转化为NO2的热化学方程式 ;  NiO(OH)+MH
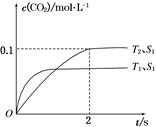
NiO(OH)+MH 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。