题目内容
(本题共8分)
现有200mL混合溶液,其中含FeI2、FeBr2各0.10mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其它反应)
(1)滴入少量氯水时被氧化的元素是 ,氧化产物是 (填化学式)
(2)若有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是 。
(3)若原溶液中Br—有一半被氧化,共消耗Cl2的物质的量为 ,若最终所得溶液为400mL,其中主要阳离子的物质的量浓度为 。
(4)往上述反应后的溶液中滴入淀粉溶液,溶液变蓝。继续滴入过量氯水,蓝色褪去,试写出有关反应的离子方程式并分析电子转移情况:
。
(1)-1价的I,I2。 (2)Cl-、Br-; (3)0.25mol(2分),0.5mol/L
(4)I2 + 6H2O +5Cl2 ===2IO3-+10Cl-+12H+(2分)
解析

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
|
元素编号 |
元素性质与原子(或分子)结构 |
|
T |
最外层电子数是次外层电子数的3倍 |
|
X |
常温下单质为双原子分子,分子中含有3对共用电子对 |
|
Y |
M层比K层少1个电子 |
|
Z |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
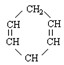 可简写为
可简写为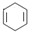 。现有某化合物W的分子结构可表示为
。现有某化合物W的分子结构可表示为 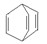 。根据题意回答:
。根据题意回答: