题目内容
(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
|
元素编号 |
元素性质与原子(或分子)结构 |
|
T |
最外层电子数是次外层电子数的3倍 |
|
X |
常温下单质为双原子分子,分子中含有3对共用电子对 |
|
Y |
M层比K层少1个电子 |
|
Z |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
(10分)(1) 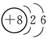 (2分)
(2) Na(2分) c、d (2分)
(2分)
(2) Na(2分) c、d (2分)
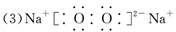 (2分)
(4)N2H4+2H2O2===N2↑+4H2O(2分)
(2分)
(4)N2H4+2H2O2===N2↑+4H2O(2分)
【解析】依题意可知T为氧X为氮Y为钠Z为铝,元素T和氢元素可形成一种18电子的化合物Q为N2H4,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W H2O2,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,为N2H4+2H2O2===N2↑+4H2O

(本题共8分)
NO和CO都是有毒的气体,利用催化技术能够将它们转变成无毒的CO2和N2。一定量的NO和CO进行如下反应:2NO+2CO 2CO2+N2,其部分化学平衡常数如下表:
2CO2+N2,其部分化学平衡常数如下表:
| T(℃) | 0 | 50 | 100 |
| K | 0.5 | 1.05 | 2.56 |
1.若把化学方程式写为NO+CO
 CO2+1/2N2,则100℃时,K的值= 。
CO2+1/2N2,则100℃时,K的值= 。2.上述反应达到化学平衡后,下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
3.若上述反应在容积不变的密闭容器中进行,该可逆反应达到平衡的标志是____
A.气体的密度不再变化
B.单位时间内消耗的CO与生成的CO2的物质的量之比为1︰1
C.气体的压强不再变化
D.各气体的浓度相等
4.某温度下,将0.02 mol的NO和0.02 mol的CO的混合气体充入一装有催化剂的容器中,充分反应后,测得混合气体中CO的体积分数为0.125,则CO的转化率为 。