题目内容
下列方法中,不能用于实验室制备氨气的是
| A.加热浓氨水 | B.将浓氨水滴到生石灰上 |
| C.加热氯化铵固体 | D.将熟石灰和氯化铵的混合物加热 |
C
A:NH3·H2O=NH3↑+H2O
B:生石灰遇到可放出大量的热:NH3·H2O=NH3↑+H2O
C:虽然氯化铵可加热分解生成氨气,但两气体又重新化合为氯化铵,故一般不用氯化铵来制取氨气
D:2NH4Cl+Ca(OH)2 =CaCl2+2NH3↑+2H2O
答案为C
B:生石灰遇到可放出大量的热:NH3·H2O=NH3↑+H2O
C:虽然氯化铵可加热分解生成氨气,但两气体又重新化合为氯化铵,故一般不用氯化铵来制取氨气
D:2NH4Cl+Ca(OH)2 =CaCl2+2NH3↑+2H2O
答案为C

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 分是CuCO3·Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:
分是CuCO3·Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下: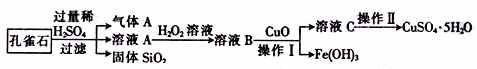
 仪器在此操作中的主要作用是 。
仪器在此操作中的主要作用是 。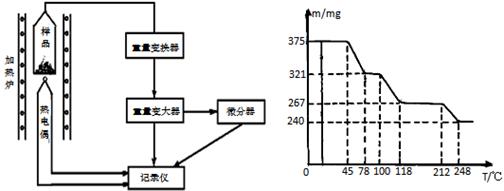
 密度为1.84 g·mL-1)_____________mL。
密度为1.84 g·mL-1)_____________mL。 另一个盛有适量蒸馏水的量筒中稀释,并冷却到室温;
另一个盛有适量蒸馏水的量筒中稀释,并冷却到室温; ,若空格不够可以补加)。
,若空格不够可以补加)。 图所示实验装置进行实验(图中a、b、c表示止水夹)。
图所示实验装置进行实验(图中a、b、c表示止水夹)。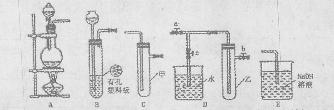
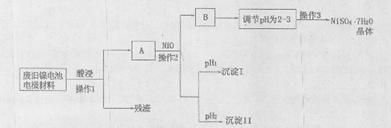
 则下列推断正确的是
则下列推断正确的是

 HgO在内的各试剂的名称____________________。将HgO加放F中的操作方法是________________
HgO在内的各试剂的名称____________________。将HgO加放F中的操作方法是________________