题目内容
下列装置或操作能达到实验目的的是
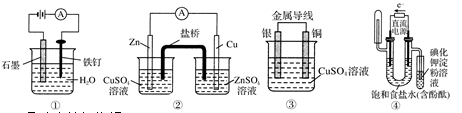

| A.①防止铁钉生锈 |
| B.②构成铜锌原电池 |
| C.③构成铜银原电池 |
| D.④验证NaCl溶液(含酚酞)电解产物 |
D
略

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
题目内容

| A.①防止铁钉生锈 |
| B.②构成铜锌原电池 |
| C.③构成铜银原电池 |
| D.④验证NaCl溶液(含酚酞)电解产物 |

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案