题目内容
2.已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O═4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是( )| A. | 该反应中Na2O2既是氧化剂又是还原剂,O2是还原产物 | |
| B. | 若Fe2+失去4mol电子,生成氧气的体积约为22.4L | |
| C. | 4 mol Na2O2在反应中共得到6NA个电子 | |
| D. | 反应过程中可以看到白色沉淀先转化为灰绿色后转化为红褐色 |
分析 A.Fe元素的化合价由+2价升高为+3价,过氧化钠中O元素的化合价由-1价升高为0,由-1价降低为-2价;
B.若Fe2+失去4mol电子,则参加反应得到Fe2+为4mol,可知生成的氧气为1mol,氧气不一定处于标况下;
C.过氧化钠中氧元素化合价从-1价升高到0价,降低到-2价,4mol过氧化钠有1mol做还原剂,3mol做氧化剂;
D.Fe2+氧化生成Fe(OH)3,看不到白色沉淀先转化为灰绿色后转化为红褐色.
解答 解:A.Fe元素的化合价由+2价升高为+3价,过氧化钠中O元素的化合价由-1价升高为0,由-1价降低为-2价,反应中Na2O2既是氧化剂又是还原剂,O2是氧化产物,故A错误;
B.若Fe2+失去4mol电子,则参加反应得到Fe2+为4mol,可知生成的氧气为1mol,氧气不一定处于标况下,氧气的体积不一定为22.4L,故B错误;
C.过氧化钠中氧元素化合价从-1价升高到0价,降低到-2价,4mol过氧化钠有1mol做还原剂,3mol做氧化剂,Na2O2在反应中得到电子6mol电子,即得到6NA个电子,故C正确;
D.Fe2+氧化生成Fe(OH)3,反应过程中看不到白色沉淀转化为灰绿色再转化为红褐色沉淀的现象,故D错误,
故选:C.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念和转移电子数的考查,题目难度中等.

练习册系列答案
相关题目
12.有些化学仪器加热时需要放在石棉网上,但也有一些仪器可以直接在酒精灯上加热,下列各组仪器中可以用酒精灯直接加热的一组是( )
| A. | 坩埚、烧杯 | B. | 试管、燃烧匙 | C. | 蒸发皿、平底烧瓶 | D. | 蒸发皿、圆底烧瓶 |
10.化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
| A. | 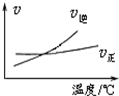 根据图可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. | 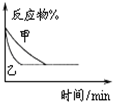 如图表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 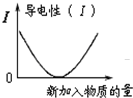 如图可表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 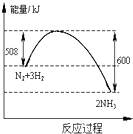 如图④是N2与H2合成氨的能量变化曲线,可确定该反应1mol N2和4molH2充分反应时放热一定等于92kJ |
17.在下述条件下,一定能大量共存的离子组是( )
| A. | 透明的水溶液中:K+、Mg2+、SO42-、MnO4- | |
| B. | 含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ | |
| C. | 在pH=7的溶液中:Na+、Fe3+、SO42-、Br- | |
| D. | 强碱性溶液中:ClO-、S2-、HSO3-、Na+ |
7.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | 2 Fe3++2 I-═2 Fe2++I2 | B. | Cl2+FeI2═FeCl2+I2 | ||
| C. | Co2O3+6 HCl═2 CoCl2+Cl2+3 H2O | D. | 3 Cl2+6 FeI2═2 FeCl3+4 FeI3 |
11.下列实验操作中正确的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,再移走酒精灯停止加热 | |
| B. | 蒸馏实验中,温度计的水银球应插入液态混合物中 | |
| C. | 开始蒸馏时,应该先开冷凝水,再点燃酒精灯;蒸馏完毕,应先撤酒精灯再关冷凝水 | |
| D. | 萃取操作时,应选择合适的有机萃取剂,且萃取剂的密度必须比水大 |
12.1.5molH2含有的氢原子数为( )
| A. | 1.5 | B. | 3 | C. | 6.02×1023 | D. | 1.806×1024 |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
 .
.