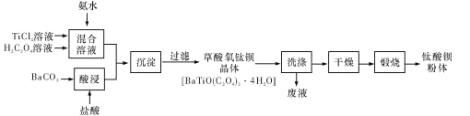
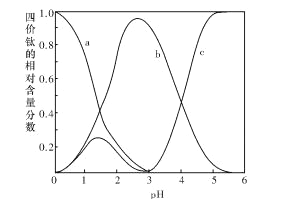
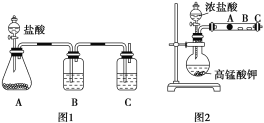
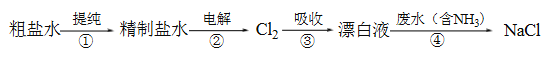题目内容
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
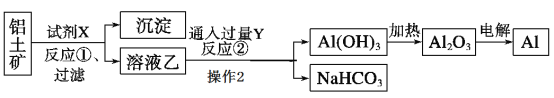
(1)试剂X应选择________(选填“氢氧化钠溶液”、“盐酸”),反应①过滤后所得沉淀为__ ;反应①的离子方程式_____;
(2)反应②中Y是_____(写化学式);
(3)写出由Al(OH)3加热为Al2O3的反应方程式_______
【答案】氢氧化钠溶液 Fe2O3 Al2O3+2OH- =2AlO2-+H2O CO2 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
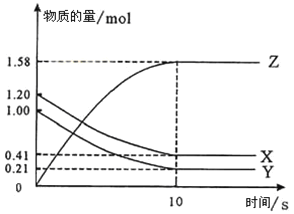
由于Al2O3属于两性氧化物,而Fe2O3属于碱性氧化物,所以应选用氢氧化钠溶液溶解Al2O3;由溶液乙通入过量的Y生成氢氧化铝沉淀、碳酸氢钠可知,溶液乙中含有偏铝酸根、气体Y为二氧化碳;过量的二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀与碳酸氢钠,据此可解题。
(1)由上述分析可以知道,试剂X应选择氢氧化钠溶液,氧化铁与氢氧化钠不反应,反应①后过滤所得沉淀为氧化铁;反应①为Al2O3和氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH- =2AlO2-+H2O;
因此,本题正确答案是:氢氧化钠溶液 ;Fe2O3 ;Al2O3+2OH- =2AlO2-+H2O;
(2)反应②为偏铝酸钠溶液和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,则Y是CO2;
因此,本题正确答案是:CO2;
(3)Al(OH)3加热生成Al2O3和水,反应方程式为:2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。

【题目】某同学设计实验制备2-羟基-4-苯基丁酸乙酯,反应原理、装置和数据如下:


相对分子质量 | 密度(g/cm3) | 沸点(℃) | 水溶性 | |
2-羟基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
乙醇 | 46 | 0.789 | 78.4 | 易溶 |
2-羟基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 难溶 |
实验步骤:
①如图1,在干燥的圆底烧瓶中加入20mL2-羟基-4-苯基丁酸、20mL无水乙醇和适量浓硫酸,再加入几粒沸石;
②加热至70℃左右保持恒温半小时;
③分离、提纯三颈瓶中的粗产品,得到有机粗产品;
④精制产品。
请回答下列问题:
(1)油水分离器的作用为____________________。实验过程中发现忘记加沸石该如何操作_______________________。
(2)本实验采用____________加热方式(填“水浴”、“油浴”或“酒精灯加热”)。
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液和水洗涤。第二次水洗的目的是___________________。
(4)在精制产品时,加入无水MgSO4的作用为___________________;然后过滤,再利用如图2装置进行蒸馏纯化,图2装置中的错误有__________________________。
(5)若按纠正后的操作进行蒸馏纯化,并收集212℃的馏分,得2-羟基-4-苯基丁酸乙酯约9.0g。则该实验的产率为__________________________。