题目内容
18.下列离子方程式书写正确的是( )| A. | 铁与硫酸铜溶液反应:Fe+Cu2+=Fe2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸钙与盐酸反应:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ |
分析 A.反应生成硫酸亚铁和铜;
B.不符合反应客观事实,生成产物为硫酸亚铁和氢气;
C.碳酸钙为沉淀,应保留化学式;
D.漏掉氢离子与氢氧根离子的反应.
解答 解:A.铁与硫酸铜溶液反应,离子方程式:Fe+Cu2+=Fe2++Cu,故A正确;
B.稀 H2SO4与铁粉反应,离子方程式:Fe+2H+=Fe2++H2↑,故B错误;
C.碳酸钙与盐酸反应,离子方程式:CaCO3+2H+=CO2↑+H2O+Ca2+,故C错误;
D.氢氧化钡溶液与稀硫酸反应,离子方程式:2H++2OH-+Ba2++SO${\;}_{4}^{2-}$=BaSO4↓+2H2O,故D错误;
故选:A.
点评 本题考查离子反应方程式书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意化学式的拆分、注意反应必须符合客观事实.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
8.分子式为C4H8O3的有机物在一定条件下具有如下性质:
①在浓硫酸存在下,能与CH3CH2OH、CH3COOH反应;
②在浓硫酸存在下,能脱水生成一种能使溴水褪色的物质,该物质只存在一种结构;
③在浓硫酸存在下,能生成一种分子式为C4H6O2的五元环状化合物;
则C4H8O3的结构简式为( )
①在浓硫酸存在下,能与CH3CH2OH、CH3COOH反应;
②在浓硫酸存在下,能脱水生成一种能使溴水褪色的物质,该物质只存在一种结构;
③在浓硫酸存在下,能生成一种分子式为C4H6O2的五元环状化合物;
则C4H8O3的结构简式为( )
| A. | HOCH2COOCH2CH3 | B. | CH3CH(OH)CH2COOH | C. | HOCH2CH2CH2COOH | D. | CH3CH2CH(OH)COOH |
9.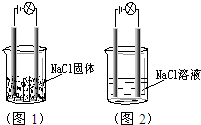 一化学兴趣小组在家中进行化学实验,按照图1连接 好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接 好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
 一化学兴趣小组在家中进行化学实验,按照图1连接 好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接 好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | |
| B. | 将图2中的NaCl溶液换成液态HCl,灯泡也亮 | |
| C. | 将图2中的NaCl溶液换成SO2的水溶液,灯泡也亮,说明SO2是电解质 | |
| D. | 电解质本身不一定能导电 |
10.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是( )
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 13.8g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 13.8g混合物恰好能与50ml盐酸完全反应 | |
| B. | 根据表中数据不能计算出混合物中NaHCO3的质量分数 | |
| C. | 向50ml盐酸中加入混合物27.6g时,盐酸过量 | |
| D. | 盐酸的物质的量浓度为5.0mol/L |
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温下,23g NO2含有NA个氧原子 | |
| B. | 1mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 标准状况下,22.4 L盐酸含有NA个HCl分子 | |
| D. | 常温常压下,22.4L CO2中含有NA个CO2分子 |
15.下列做法不利于改善大气污染状况的是( )
| A. | 提倡低碳生活 | B. | 大力发展私家车 | ||
| C. | 充分利用太阳能、风能 | D. | 煤的气化或液化处理 |