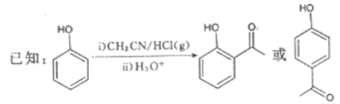
题目内容
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能(kJ/mol) | 630 | 243 | a | 607 |
则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=____kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=____kJ/mol。
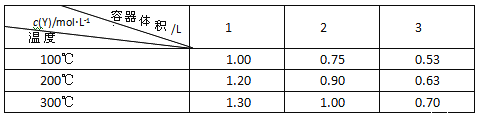
(2)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
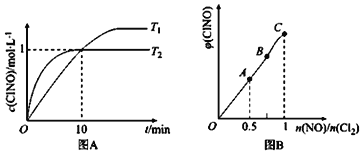
① 由图A可判断T1 ____T2,该反应的△H____0 (填“>”“<”或“=”)。
② 反应开始到10min时NO的平均反应速率v(NO)=______mol/(L·min)。
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是________点。
【答案】289-2a<<0.1A
【解析】
(1)2NO(g)+C12(g)![]() 2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和;(2)由图象可知T2先达到平衡状态,且生成物的浓度小,则升高温度平衡逆向移动;(3)n(NO)/n(C12)的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大。
2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和;(2)由图象可知T2先达到平衡状态,且生成物的浓度小,则升高温度平衡逆向移动;(3)n(NO)/n(C12)的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大。
(1)反应的△H=反应物的总键能-生成物的总键能,则△H=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol;
(2)①根据图象先拐先平可知T1<T2,温度越高,反应速率越大,降低温度c(C1NO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0;
②在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),10min时c(ClNO)=1mol/L,则此时c(NO)=1mol/L,v(NO)=![]() =0.1mol/(Lmin);
=0.1mol/(Lmin);
(3)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小,所以应该是F点,NO的物质的量越小其转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,为A点。

【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-31 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_____________________________________________________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________________________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到____________,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5 mol·L-1时,认为该离子沉淀完全)。
(3)滤渣B的成分是______________。
(4)碱性锌锰电池中,MnO2参与的电极反应式为__________________________________。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为___________________________________。
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.920 0 g该样品,与足量酸性KI溶液充分反应后,配制成100 mL溶液。取其中10.00 mL,恰好与25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。计算可得该样品纯度为_____________。(保留一位小数)
)。计算可得该样品纯度为_____________。(保留一位小数)