题目内容
已知T℃,PkPa时,在容器甲和容器乙中分别充入1mo1A(g)和1 molB(g),发生反应A(g)+B(g) C(g) DH<0,反应过程中温度保持不变。已知起始时V乙
C(g) DH<0,反应过程中温度保持不变。已知起始时V乙
 V甲,装置如下图所示。当反应达平衡时,测得甲中C的体积分数为40%。下列说法中不正确的是
V甲,装置如下图所示。当反应达平衡时,测得甲中C的体积分数为40%。下列说法中不正确的是
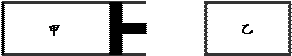
 C(g) DH<0,反应过程中温度保持不变。已知起始时V乙
C(g) DH<0,反应过程中温度保持不变。已知起始时V乙
 V甲,装置如下图所示。当反应达平衡时,测得甲中C的体积分数为40%。下列说法中不正确的是
V甲,装置如下图所示。当反应达平衡时,测得甲中C的体积分数为40%。下列说法中不正确的是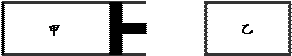
| A.容器甲、乙中反应的起始速率不等 |
| B.达平衡时,容器甲、乙中各组分的体积分数不等 |
| C.达平衡时,容器甲、乙中放出的热量相等 |
| D.达平衡时,容器乙中再充入少量稀有气体,A的转化率不变 |
B
通过达平衡时甲中C的体积分数可计算平衡时容器甲的体积,设A的转化率为x,
A(g) + B(g)
 C(g) ?H<0
C(g) ?H<0起始:1 mol 1 mol 0
转化:xmol xmol xmol
平衡:(1-x)mol (1-x)mol xmol
40%==
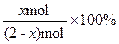 ,解得x
,解得x
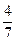 mol,反应后气体的总物质的量为
mol,反应后气体的总物质的量为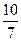 mol,容器的容积为原来的
mol,容器的容积为原来的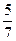 ,现由于起始时V乙
,现由于起始时V乙
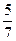 V甲,且投料量相同,所以V甲和
V甲,且投料量相同,所以V甲和V乙二种状态属于等效平衡,因此B错。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2Z(g)+W(g);ΔH<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是
2Z(g)+W(g);ΔH<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是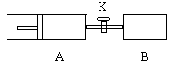
 4C+6D。达到平衡时,测得A的转化率大于B的转化率。则n的取值范围正确的是
4C+6D。达到平衡时,测得A的转化率大于B的转化率。则n的取值范围正确的是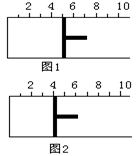

 2Z(g)其中X2、Y2、Z的起始溶度分别为0.10 mol/L、0.30 mol/L、0.20 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g)其中X2、Y2、Z的起始溶度分别为0.10 mol/L、0.30 mol/L、0.20 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
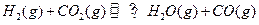 的平衡常数
的平衡常数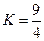 .该温度下在甲、乙、丙三个恒容密闭容器中,
.该温度下在甲、乙、丙三个恒容密闭容器中,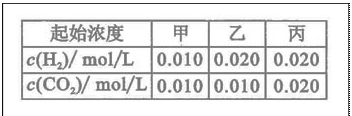
 C(g),可以判断达到化学平衡状态的是
C(g),可以判断达到化学平衡状态的是 N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是( )。
N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是( )。