题目内容
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1molL-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
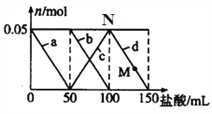
A. b和c曲线表示的是同一个离子反应
B. N点时生成的CO2为0.05mol
C. M点时Al(OH)3的质量等于3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1 :1
【答案】B
【解析】A.向Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1molL-1的HCl溶液,首先发生反应AlO2-+H++H2O=Al(OH)3↓,a曲线表示AlO2-的减少,第二阶段,CO32-反应完毕,发生反应HCO3-+H+=CO2↑+H2O,此阶段Al(OH)3不参与反应,b曲线表示碳酸钠和盐酸反应,c曲线表示碳酸氢钠的生成,d线表示HCO3-减少,则A、b曲线表示碳酸钠和盐酸反应,c曲线也表示碳酸钠和盐酸的反应,只是b曲线表示碳酸钠的物质的量,c曲线表示碳酸氢钠的物质的量,所以b和c曲线表示的离子反应是相同:CO32-+H+=HCO3-,A正确;B、N点恰好是碳酸氢钠溶液,没有CO2产生,B错误;C、盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO32-反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n[Al(OH)3]=n(NaAlO2)=n(HCl)0.05mol,m[Al(OH)3]=0.05mol×78g/mol=3.9g;C正确;D、由图象知,Na2CO3、NaAlO2的物质的量相等都是0.05mol,由此判断溶液中CO32-与AlO2-的物质的量之比为1:1,D正确;答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案